
Глава 2. Упругость, неупругость и сверхупругость
Тем, кто еще не читал записных книжек И. Ильфа, можно только позавидовать - у них впереди огромное удовольствие. Там, среди прочих, есть такая запись: - Книга по высшей математике начиналась словами "Мы знаем...". Хотя наш предмет проще высшей математики, все же и нам придется предполагать, что кое-что мы уже знаем.
Итак, "мы знаем", что при обычных условиях затвердевания жидкого металла его атомы располагаются в пространстве в строго определенном геометрическом порядке, образуя кристаллическую решетку. При комнатной температуре и атмосферном давлении любой металл, за исключением ртути, представляет собой твердое кристаллическое тело. Да и ртуть кристаллизуется уже при -39°С, так что при сильных морозах ртутные термометры непригодны.
Не случайно сказано: "при обычных условиях затвердевания". Дело в том, что при охлаждении с огромными скоростями - порядка миллиона градусов в секунду - можно подавить процесс кристаллизации и сохранить при комнатной температуре взаимное расположение атомов, характерное для жидкого металла. В этом случае получится аморфный металл или металлическое стекло, т. е. твердое (иногда даже очень твердое), но не кристаллическое тело. О металлических стеклах мы поговорим позднее, а пока продолжим наш рассказ.
Металл закристаллизовался, расставив свои частицы в определенном порядке. Раньше для простоты мы называли эти частицы атомами. Теперь уточним: частицы, располагающиеся в узлах кристаллической решетки - это ионизирозанные атомы, положительно заряженные ионы. Характер химической связи в металлических кристаллах таков, что атомы отдают часть внешних валентных электронов как бы в общее пользование. Получается, что остов из ионов плавает в облаке "электронного газа", омывается обобществленными электронами, не принадлежащими ни одному из них в отдельности.
Формирование ионного скелета металла, кристаллической решетки, его способность сохранять (в отличие от газа и жидкости) полученную при затвердевании форму и даже противостоять довольно мощным внешним силовым воздействиям - все это обеспечивается силами межатомного взаимодействия.
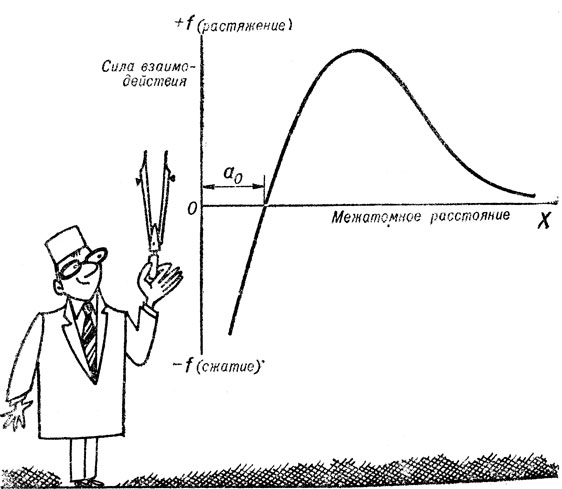
Рис. 9
Природа сил межатомного взаимодействия и законы, их определяющие, исследуются методами квантовой механики и являются достаточно сложными. На рис. 9 качественно показана зависимость равнодействующей всех сил, действующих на два соседних иона, от расстояния между ними. Для нас сейчас важны следующие два обстоятельства.
Во-первых, сила взаимодействия f равна нулю в точке, определяющей равновесное расстояние между ионами а0. Во-вторых, вблизи точки равновесия зависимость силы взаимодействия от расстояния между ионами близка к линейной. Это позволяет предложить довольно грубую" но зато наглядную модель строения кристалла (рис. 10). Его можно представить в виде пружинок, к концам которых прикреплены ионизированные атомы, занимающие узлы решетки. Пружинки можно считать ненагруженными (f = 0), но если появится внешняя сила, требующая увеличения размера тела, например, в направлении X, они сразу же начнут работать, стремясь сохранить целостность ансамбля атомов (ионов). Всякая попытка деформировать или разрушить металл наталкивается на противодействие этих "пружин".
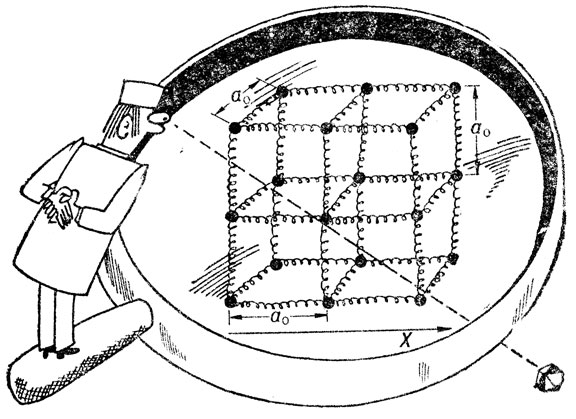
Рис. 10
Если мы попытаемся удалить атомы друг от друга (увеличить X), возникнет сила взаимного притяжения (+f), которая будет стремиться вернуть атомы в исходные позиции, находящиеся на расстоянии а0 друг от друга. Попытка сблизить атомы (уменьшить X) ведет к появлению силы обратного знака (-f), стремящейся снова восстановить начальное состояние. Этими особенностями межатомного взаимодействия и обусловлены, во-первых, само свойство упругости металлов, а, во-вторых, - закон упругой деформации, известный как закон Гука.
|
ПОИСК:
|
© METALLURGU.RU, 2010-2020
При использовании материалов сайта активная ссылка обязательна:
http://metallurgu.ru/ 'Библиотека по металлургии'
При использовании материалов сайта активная ссылка обязательна:
http://metallurgu.ru/ 'Библиотека по металлургии'