
§ 16. Коррозия металлов
Коррозией называют самопроизвольное разрушение материалов вследствие взаимодействия с окружающей средой. В переводе с латинского коррозия означает разъедание. Все металлы и сплавы, за исключением золота, в свободном виде в условиях земной атмосферы неустойчивы. Точно также неустойчивы они в пресной и морской воде и во всех растворах и расплавах, используемых в технике и быту. Неустойчивость в данном случае оценивается с позиций термодинамики и означает, что металлы и сплавы самопроизвольно переходят в окислы, различные сложные соединения, водные растворы. Эти превращения совершаются, как правило, через много ступеней и в течение более или менее длительного Бремени в зависимости от условий. Типичные примеры коррозии - ржавление железа, образование зелено-бурого налета на поверхности меди и ее сплавов, тускнение серебра на воздухе, образование окислов на поверхности всех металлов при нагреве на воздухе, растворение металлов в водных растворах кислот, щелочей, солей.
Коррозия приводит к огромным безвозвратным потерям металлов. Борьба с коррозией ведется путем научно обоснованного подбора металлических материалов для заданных условий работы, а также путем раз работки сплавов с повышенной коррозионной стойкостью. Для борьбы с коррозией разработаны разнообразные способы защиты металлов.
Характер коррозионного разрушения металлов может быть весьма разнообразным. Он может происходить как равномерно по всей площади соприкосновения металла с окружающей средой, так и отдельными пятнами и очагами, например в виде отдельных точек (питтинговая коррозия). Может происходить преимущественное разрушение по границам зерен, в результате которого резко снижается прочность металла (межкристаллитная коррозия). Наблюдается также самопроизвольное растрескивание металла. Последние два случая наиболее опасны, поскольку сопровождаются катастрофической потерей прочности при ничтожном уменьшении массы металла.
Во всех случаях коррозии металлических материалов происходит переход атомов металлов, находившихся в кристаллической решетке, в водные растворы, окислы и другие химические соединения. При этом чаще всего атомы превращаются в ионы с определенным положительным зарядом (катионы). Таким образом, коррозия с химической точки зрения выражается в повышении положительного заряда атомов металлов в результате отдачи электронов, иначе говоря, сопровождается окислением металлов.
Из химии известно, что окисление (повышение положительной валентности) одного элемента должно происходить за счет восстановления (повышения отрицательной валентности) другого элемента. В зависимости от формы и условий протекания процесса восстановления элемента-окислителя различают химическую коррозию и электрохимическую.
Химической коррозией называют такие процессы, при которых окисление металла и восстановление окислительного элемента происходят в одном акте, т. е. одновременно и в одном месте. Примером химической коррозии является окисление металлов - взаимодействие металлов с кислородом воздуха, с газообразным хлором, с жидкой серой и нефтепродуктами, содержащими серу, вообще взаимодействие металлов с жидкостями, не являющимися электролитами (спирт, ацетон, фреоны, сжиженный природный газ и т. д).
Наиболее практически важным случаем химической коррозии является окисление металлов. Процесс окисления обычно выражается в образовании и росте пленки окислов на поверхности металла. В том случае, когда удельный объем окисной пленки близок к удельному объему металла, пленка существенно замедляет дальнейшее его окисление. Если же плотности окисла и металла различны, в пленке возникают напряжения, она надрывается или сморщивается, и по образовавшимся трещинам кислород воздуха продолжает беспрепятственно поступать к поверхности металла. Скорость окисления в этих случаях почти не меняется во времени. При образовании сплошной защитной пленки окислов процесс окисления связан с диффузией сквозь нее кислорода от свободной поверхности к поверхности раздела металл - окисел и с диффузией металла в противоположном направлении. Скорость диффузии, как известно, существенно растет с увеличением температуры, поэтому нагрев повышает скорость окисления.
Окисление сплавов протекает значительно более сложно, чем окисление чистых металлов. Если сплав представляет собой однородный твердый раствор двух металлов, то обычно при воздействии кислорода на поверхности образуется слой окисла менее благородного металла, т. е. металла, дающего окисел с большей величиной уменьшения свободной энергии (часто говорят, что такой металл обладает большим сродством к кислороду). Иногда на поверхности возникают сложные окислы, содержащие оба металла.
Исходя из представлений о механизме окисления, разрабатываются составы сплавов, стойких к воздействию кислорода при повышенных температурах. Такие сплавы называются жаростойкими, основой их являются железо, никель медь. Обычно в их состав вводят компоненты, способные давать химически прочные окислы (алюминий, хром, бериллий, кремний). На поверхности жаростойких сплавов возникает защитный слой, состоящий либо из чистого окисла добавленного легирующего компонента, либо из сложного окисла основы и легирующего компонента. Скорость окисления (газовой коррозии) при этом уменьшается в десятки раз в сравнении с окислением чистой основы.
Окисление многофазных сплавов определяется суммой частных процессов окисления отдельных фаз. При этом большое значение имеет не только природа фазы, но и ее общий объем в структуре сплава, форма и величина частиц. Чистота обработки поверхности металла заметно сказывается на начальных стадиях химической коррозии. Чем тщательнее и чище обработана поверхность, тем устойчивее и прочнее образующиеся защитные пленки и тем больше сопротивление металла химической коррозии.
Электрохимическая коррозия охватывает процессы, при которых ионизация (окисление) металла и восстановление элемента-окислителя осуществляются не в одном месте, так что электроны, освобождающиеся при ионизации металла, перемещаются на некоторое расстояние к участкам, где они связываются с элементом-окислителем и восстанавливают его. Как видно, эти случаи коррозии связаны с перемещением электронов, т. е. с электрическим током, именно поэтому они и называются электрохимической коррозией. Электрохимическая коррозия имеет место при взаимодействии металлов с жидкостями-электролитами: водой и водными растворами кислот, солей, щелочей, расплавленными солями, щелочами и окислами.
Электрохимическая коррозия металла включает в себя два идущих одновременно электродных процесса - анодный и катодный (рис. 34). Анодный процесс состоит из собственно растворения металла, при этом ионы металла уходят в раствор, а электроны остаются в неразрушенном металле. Катодный процесс выражается в связывании избыточных электронов положительно заряженными ионами (но не ионами данного металла), имеющимися в электролите и подходящими к поверхности металла в процессе диффузии и конвекции. При определенных условиях в зависимости от состава среды и ее кислотности связывание электронов осуществляется нейтральными атомами, при этом образуются отрицательно заряженные ионы. В реальных условиях в катодных процессах особенно велика роль ионов водорода и нейтрального кислорода, находящегося в растворе. На катоде ионы водорода превращаются сначала в атомарный, затем в молекулярный водород, который уходит в атмосферу. Молекулы растворенного кислорода, взаимодействуя с электронами и молекулами воды, превращаются в отрицательно заряженные гидроксильные группы ОН-. В первом случае процесс на катоде называют водородной деполяризацией, во втором - кислородной деполяризацией.
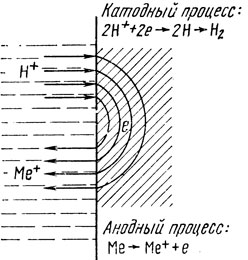
Рис. 34. Схема процесса электрохимической коррозии
Поскольку общий процесс электрохимического разрушения металла невозможен без катодного процесса, условия его осуществления во многом предопределяют стойкость материала. Насыщенность электролита кислородом и повышенная кислотность среды ухудшают стойкость металлических материалов. В электрохимической коррозии решающее значение имеют так называемые электродные потенциалы металлов в растворах-электролитах. Электродный потенциал возникает на металле, погруженном в электролит, вследствие того, что атомы металла, растворяясь в электролите, покидают кристаллическую решетку в виде положительно заряженных ионов. Оставшиеся в решетке электроны вызывают появление электрического потенциала. Абсолютную величину этого потенциала измерить невозможно, поэтому условно принимают за нуль потенциал ионизации водорода в электролитах, а потенциалы металлов измеряют относительно него.
Электродные потенциалы могут быть отрицательными и положительными. Так, отрицательные потенциалы имеют магний (-2,3 В), цинк (-0,75 В), железо (-0,44 В). Положительными электродными потенциалами обладают медь: +0,3 В при переходе в двухвалентное состояние и +0,5 В при переходе в одновалентное состояние, а также ртуть ( + 0,75 В), серебро ( + 0,78 В). Электродный потенциал определяет склонность металла переходить в электролит: чем более отрицателен потенциал, тем больше склонность металла к переходу в электролит.
В реальных условиях металлы неоднородны. На поверхность металла выходят кристаллические зерна разных ориентировок, состав металла в пределах одного зерна различен из-за микроликвации, возникающей при дендритной кристаллизации, сам сплав может иметь неоднофазное строение, в металле всегда присутствуют инородные включения окислов, шлака, флюсов. Из-за этой неизбежной неоднородности разные участки поверхности металла приобретают в электролите различные потенциалы. Участки с более отрицательным потенциалом играют роль анодов, участки с более положительным потенциалом - роль катодов. Электроны перетекают от анодов к катодам по телу металла, при этом происходит растворение анодных участков. В результате весь металл постепенно разрушается.
Если фазовая составляющая структуры сплава, являющаяся в данных условиях анодом, распределена так, что образует непрерывную сетку, то коррозионная стойкость такого сплава невысокая, поскольку разрушение свободно распространяется в глубь металла. Такой случай наблюдается при коррозии двухфазных латуней, где β-фаза является анодом. В нержавеющих сталях типа Х15Н10 разрушаются пограничные участки зерен, обедненные хромом. В сплавах типа дюралюминий разрушение идет по пограничным выделениям фазы СuАl2.
Если же анодная фаза расположена в структуре сплава в виде изолированных частиц, то коррозионная стойкость снижается очень мало в сравнении с тем, когда такие выделения вообще отсутствуют. Примером могут служить алюминиевые сплавы, упрочненные частицами силицида магния Mg2Si.
Механические напряжения, особенно напряжения растяжения, увеличивают отрицательный потенциал металла, поэтому они усиливают электрохимическую коррозию. По той же самой причине коррозия усиливается в тех случаях, когда электрохимическому воздействию подвергается грубая свежеобработанная поверхность металла.
В некоторых случаях металлы приобретают резко повышенную коррозионную стойкость в растворах электролитов. Этим свойством обладают титан, алюминий, хром, железо, никель и ряд других металлов. При этом наблюдается резкое смещение электродного потенциала в положительную сторону, Так, если обычный потенциал железа равен - 0,44 В, то в пассивном состоянии железо приобретает потенциал +(0,5-1,0) В. Именно это изменение потенциала и обусловливает пассивность подобных металлов.
Пассивирование металлов достигается обработкой их сильными окислителями или электролитическим анодированием, при котором металл помещают в электролизную ванну, где он окисляется выделяющимся кислородом. На пассивированных металлах резко замедлены анодные процессы, поскольку на поверхности имеются либо прочные окисные пленки, либо надежно адсорбированный кислород.
Для уменьшения опасности разрушения от электрохимической коррозии металл необходимо использовать в наиболее равновесном состоянии, без внутренних напряжений, с изолированными выделениями фаз, могущих быть анодами. Желательно перевести металл в пассивное состояние. Среда, в которой будет работать металл, по возможности, должна содержать наименьшее количество элементов деполяризаторов (кислорода и водорода) или же их доставка к поверхности металла должна быть затруднена.
Для защиты от электрохимической коррозии используют особый способ, так называемую протекторную защиту. Протектором служит специальный сплав с большим отрицательным потенциалом. Болванки из этого сплава помещают вместе с рабочим металлом в коррозионную среду, между протекторным сплавом и защищаемым металлом создается надежный электрический контакт. В таких условиях протектор работает как анод и интенсивно разрушается, а защищаемый металл служит катодом, где идет процесс деполяризации - связывание электронов, перемещающихся от анода. В качестве протекторов используют сплавы на основе магния. Весьма эффективна от электрохимической коррозии электрозащита. В этом случае защищаемое изделие подсоединяют к отрицательному полюсу внешнего источника постоянного тока, а к положительному полюсу подсоединяют вспомогательный электрод из любого металла. Постепенным повышением плотности тока на изделии, которое в данном случае является катодом, можно добиться полного прекращения коррозии изделия. Это произойдет, когда подаваемый на изделие потенциал сравняется или превысит электродный потенциал металла в данной среде. Иначе говоря, искусственно увеличивая отрицательный заряд на изделии, добиваются того, что положительно заряженные ионы металла теряют возможность уходить в среду-электролит.
Для борьбы с коррозией, особенно с атмосферной, которая происходит на поверхности металла в тончайшем слое влаги, адсорбированной из воздуха, широко используются специальные вещества - замедлители коррозии, именуемые ингибиторами. Ингибиторами служат тонкие порошки солей-восстановителей (нитрит натрия) или летучие органические вещества (моноэтаноламин), не допускающие оседания влаги на поверхности металла. Ингибиторы закладывают в тару вместе с металлическими изделиями.
Защита от коррозии достигается также разнообразными покрытиями на металлах. Особенно эффективны анодные покрытия, которые оказывают защитное действие даже при отсутствии механической сплошности в результате электрохимического влияния подобно сплавам-протекторам. Цинковое покрытие на железе - типичный пример подобных покрытий. Оловянные покрытия на железе (луженая жесть) защищают основной металл только механически, при повреждении слоя олова железо оказывается, как правило, анодом и начинает усиленно ржаветь. Для защиты от коррозии широко используют никелевые и хромовые покрытия толщиной в несколько микрометров, наносимые гальваническим способом на изделия из стали, медных и цинковых сплавов. Так называемые биметаллы (железо - медь, железо - алюминий), получаемые совместной прокаткой двух металлов и имеющие на поверхности слой меди или алюминия толщиной 0,1 - 0,5 мм, были разработаны и применяются как коррозионностойкие в сравнении с железом материалы. Для защиты металлов от коррозии очень широко используют различные органические и синтетические покрытия в виде пленок, лаков, красок.
|
ПОИСК:
|
© METALLURGU.RU, 2010-2020
При использовании материалов сайта активная ссылка обязательна:
http://metallurgu.ru/ 'Библиотека по металлургии'
При использовании материалов сайта активная ссылка обязательна:
http://metallurgu.ru/ 'Библиотека по металлургии'