
Глава 2. Основы теории сплавов
§ 7. Правило фаз
Процессы, происходящие в металлах и сплавах при изменении температуры и состава, удобно рассматривать с помощью так называемого правила фаз, которое может быть строго выведено на основании законов термодинамики. Для того чтобы пользоваться этим правилом, в котором используются понятия термодинамическая система или просто система, компонент, фаза, степень свободы, необходимо уяснить значения этих понятий.
Системой в термодинамике называют совокупность веществ или тел, между которыми может беспрепятственно проходить обмен энергией и массой. Системой в данном смысле может считаться химический элемент (сера, алюминий, водород), химическое соединение (вода, поваренная соль), сплав двух и более металлов (медь - никель, олово - свинец - сурьма), водный раствор (сахар в воде), смесь газов (воздух, состоящий из азота, кислорода, углекислого газа и пяти инертных газов).
Компонентами системы называют, индивидуальные вещества, из которых состоит система. В перечисленных примерах системы химический элемент и химическое соединение содержат по одному компоненту, которыми являются железо, сера, алюминий, водород, вода, поваренная соль. Сплав двух металлов меди и никеля - двухкомпонентная система, сплав трех металлов - олова, свинца и сурьмы - трехкомпонентная система. Раствор сахара в воде - двухкомпонентная система, состоящая из компонентов - воды и сахара. Воздух как система состоит из восьми компонентов - азота, кислорода, углекислого газа и пяти инертных газов.
Фазой называется часть системы, имеющая однородное строение и отделенная от других частей поверхностью раздела. В состав фазы может входить любое число компонентов, из которых состоит система. Число фаз в системе может быть равно 1 и более. В рассмотренных примерах однокомпонентные системы при комнатной температуре состоят из одной твердой фазы, если речь идет о сере, алюминии, поваренной соли. В этих же условиях система "вода" состоит из одной жидкой фазы, а система "водород" - из одной газообразной фазы. При температурах ниже 0°С система "вода" также однофазна и состоит из одной твердой фазы - льда. При 0°С эта система двухфазна, так как при этой температуре сосуществуют жидкая (вода) и твердая (лед) фазы.
Двухкомпонентная система "раствор сахара в воде" однофазная; она состоит из одной жидкой фазы, если рассматривается ненасыщенный раствор. Эта же система будет двухфазной, если раствор насыщен и содержит нерастворившиеся кристаллы сахара, которые являются второй (твердой) фазой. В данном случае жидкая фаза содержит оба компонента - воду и сахар, а твердая - только один - сахар.
Степенями свободы называются такие параметры системы, под действием которых могут происходить изменения числа и состава фаз. Для металлов и большинства их сплавов в обычных условиях такими параметрами являются температура и состав системы.
Правило фаз формулируется следующим образом: число степеней свободы (С) системы равно числу компонентов (К) минус число фаз (Ф) плюс 1, т. е. С = К-Ф+1.
С помощью правила фаз можно определить, имеет ли система степени свободы при данном фазовом составе, т. е. может ли температура меняться при сохранении данного числа фаз или же она должна быть постоянной. Правило фаз позволяет решать и обратную задачу; по характеру изменения температуры системы можно определить имеющееся число фаз или компонентов.
Для однокомпонентной системы, состоящей из одной фазы, правило фаз дает одну степень свободы. Это означает, что система будет сохранять однофазное состояние при понижении или повышении температуры в определенных пределах. Если же в такой системе имеются две фазы, например, твердая и жидкая, то правило фаз дает 0 (нуль) степеней свободы. Такое состояние системы называют нонвариантным. Физически это означает, что пока имеются две фазы, температура однокомпонентной системы не будет меняться, несмотря на подвод или отвод энергии (тепла). Подводимая или отводимая энергия затрачивается на изменение массы фаз, при этом масса одной фазы увеличивается, а другой - уменьшается. Как только одна из фаз исчезнет и система станет однофазной, температура может меняться.
При пользовании правилом фаз следует иметь в виду, что оно справедливо для равновесного состояния системы, т. е. такого, при котором температура совершенно одинакова в любой точке системы и каждая фаза совершенно однородна по составу. Из этого следует, что изменения в системе должны совершаться с бесконечно малой скоростью так, чтобы в ней не возникали перепады температуры, а в пределах каждой фазы не появлялись участки с различным содержанием какого-либо компонента. В реальных условиях этого удается достичь далеко не всегда, поэтому правило фаз следует применять, тщательно оценивая возможное отклонение системы от равновесного состояния.
Рассмотрим с позиций правила фаз процесс кристаллизации чистого металла. Поскольку рассматривается чистый металл, система состоит из одного компонента. Здесь следует сказать, что в строгом смысле чистых металлов не существует, так как они всегда содержат примеси других элементов. Даже в наиболее чистых металлах, которые сейчас используются в технике, содержится в лучшем случае 1·10-7 % (по массе) примесей. Это значит, что в 1 г такого металла имеется около 1013÷14 атомов примесей, при этом 1 атом примеси приходится на 1010÷11 атомов основного металла. Эти цифры показывают, что называть металл чистым или загрязненным следует исходя из существа рассматриваемого явления. В данном случае при обсуждении процесса кристаллизации вполне допустимо употреблять понятие "чистый металл".
Итак, чистый металл является однокомпонентной системой. Отсюда следует, что при плавлении или кристаллизации, когда налицо две фазы, температура должна сохраняться постоянной, поскольку по правилу фаз число степеней свободы равно: С = К-Ф+1 = 1-2+1 = 0.
Эта температура называется точкой плавления или кристаллизации. Если проследить за изменением температуры во времени при охлаждении металла из жидкого состояния до комнатной температуры, то можно обнаружить важные особенности процесса кристаллизации. На рис. 11 показана типичная кривая охлаждения чистого металла из жидкого состояния от температуры t1 до комнатной температуры tкомн во времени τ.
Опыт показывает, что металл сохраняется в жидком состоянии не только тогда, когда его температура еще не достигла точки кристаллизации tкр, но и при несколько более низкой температуре. Это явление называют переохлаждением и характеризуют его разностью между температурой кристаллизации и достигнутой температурой Δt = tкр-t. Переохлаждение достигает какого-то наибольшего значения, после чего в жидкости появляются и начинают расти кристаллы. При этом температура резко поднимается до tкp и сохраняется на этом уровне до тех пор, пока идет кристаллизация. С исчезновением жидкости начинается обычное охлаждение твердого металла.
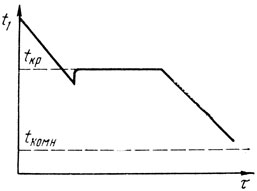
Рис. 11. Кривая охлаждения чистого металла
Появлению переохлаждения способствует высокая чистота металла, отсутствие механических сотрясений. Обычно отмечается переохлаждение в 1 - 5°С, но в отдельных случаях металлы удавалось переохладить очень сильно. Так, на железе, например, получено переохлаждение. Переохлаждение - не случайное явление. Оно необходимо для начала процесса кристаллизации по следующим причинам.
В термодинамике доказывается, что новая фаза может появиться в системе только в том случае, если ее энергетическая характеристика, называемая свободной энергией, будет меньше, чем у существующей фазы. Выше точки кристаллизации свободная энергия жидкости меньше, чем свободная энергия кристаллов, поэтому кристаллы в этих условиях не могут существовать. Ниже точки кристаллизации свободная энергия кристаллов меньше свободной энергии жидкости, и поэтому здесь устойчива твердая фаза. При температуре кристаллизации свободные энергии жидкости и кристаллов становятся одинаковыми. Однако в этих условиях самопроизвольное появление кристаллов в жидкости еще невозможно, поскольку это не приведет к снижению величины свободной энергии всей системы в целом. Только при несколько более низкой температуре, чем tкр, разница в свободной энергии твердой фазы (кристаллов) и жидкой фазы (расплава) достигает определенной величины и в жидкости может появиться твердая фаза. Этот шаг в процессе кристаллизации называют зарождением кристаллов. Для появления зародышей кристаллов необходимо такое переохлаждение, при котором разница в свободных энергиях твердой и жидкой фаз была бы достаточной, чтобы восполнить затраты энергии на образование поверхности раздела кристалл - жидкость.
Зарождение кристаллов в жидкости существенно облегчается, если в ней присутствуют примеси в виде мелких частиц. Такие частицы служат как бы готовыми подложками, для зарождения кристаллов на которых требуются значительно меньшие затраты энергии, чем для самостоятельного образования зародыша в расплаве. Поэтому зародыши кристаллов на таких частицах способны появляться при очень небольших переохлаждениях. Такое "затравливающее" действие инородных частиц ярко проявляется в том случае, когда эти частицы обладают кристаллической решеткой, с которой может сопрягаться решетка возникающих кристаллов.
Для количественного описания процесса кристаллизации используют величины - число центров кристаллизации и линейную скорость роста кристаллов. Эти величины изменяются в зависимости от переохлаждения Δt по кривым с максимумом (рис. 12). Обе кривые проходят через нуль при температуре, равной точке кристаллизации, где переохлаждение равно нулю. При очень больших переохлаждениях обе величины вновь уменьшаются до нуля. Это означает, что при этих условиях жидкость не кристаллизуется и может сохраняться в переохлажденном состоянии длительное время. Примером таких очень сильно переохлажденных жидкостей могут служить стекла, плавленый кварц, пластическая сера. Металлы обычно не удается переохладить настолько, чтобы попасть на нисходящие ветви кривых, так что с ростом переохлаждения в металлах всегда увеличивается и число центров кристаллизации и линейная скорость роста кристаллов.
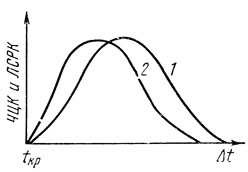
Рис. 12. Зависимость числа центров кристаллизации (ЧЦК) (1) и линейной скорости роста кристаллов (ЛСРК) (2) от переохлаждения
После появления зародышей кристаллов начинается их рост за счет присоединения атомов из жидкости. Это может проходить путем присоединения к поверхности кристалла отдельных атомов, путем возникновения на гладкой грани небольшого участка следующего атомного слоя, так называемого двумерного зародыша, и последующего его разрастания по всей грани. Наконец, наиболее вероятным является рост кристаллов за счет присоединения атомов на участках кристаллической решетки с несовершенным строением.
|
ПОИСК:
|
© METALLURGU.RU, 2010-2020
При использовании материалов сайта активная ссылка обязательна:
http://metallurgu.ru/ 'Библиотека по металлургии'
При использовании материалов сайта активная ссылка обязательна:
http://metallurgu.ru/ 'Библиотека по металлургии'