
§ 1. Атомно-электронное строение вещества. Металлы, полупроводники, изоляторы
В настоящее время известно более ста химических элементов (табл. 1). Каждый химический элемент построен из атомов одного типа. Атом представляет сложную систему, состоящую из центрального ядра и перемещающихся вокруг него электронов. Ядро сложено из нейтронов и протонов, оно имеет положительный заряд, определяемый числом протонов. Число электронов, удерживаемых ядром, равно числу протонов, поэтому одиночный атом в обычном состоянии электрически нейтрален. Электроны, перемещающиеся в атоме вокруг ядра, образуют отдельные оболочки. Распределение электронов по оболочкам подчиняется особым правилам квантовой механики. Согласно этим правилам в каждой оболочке может находиться ограниченное число электронов, которые при этом должны отличаться энергией или направлением вращения вокруг своей оси. Первая оболочка может содержать не более двух электронов, вторая - не более 8, третья - не более 18 и т. д.
В каждой оболочке электроны могут иметь только определенные энергетические состояния или уровни, обозначаемые латинскими буквами s, р d, f. Число уровней в каждой оболочке и число электронов в каждом уровне ограничены. Так, первая оболочка имеет только один s-уровень, вторая имеет два уровня - s и р, третья имеет три уровня - s, р и d. На s-уровне в любой оболочке может находиться не более двух электронов, на р-уровне - не более 6, на d-уровне - не более 10. Наименьшую энергию имеют электроны, находящиеся на s-уровнях, далее следуют электроны на р, d- и f-уровнях. Перемещение электронов вокруг ядра в атоме в обычных условиях не связано с поглощением или выделением энергии, поэтому атомы являются устойчивыми образованиями.
Между законами распределения электронов по оболочкам и периодическим законом Менделеева имеется глубокая связь. Элементы нулевой группы (инертные газы) являются элементами с полностью заполненными оболочками. Так, гелий занимает второе место в таблице Менделеева, следовательно, у него имеются два электрона, которые заполняют s-уровень в первой оболочке. Электронное строение гелия можно записать в виде 1s2, где цифра 1 обозначает номер оболочки, буква s-уровень, а число электронов записывается в виде показателя степени. Начиная с атомов лития, во втором периоде идет заполнение второй оболочки, сначала s-уровня у лития и берилия и затем р-уровня - от бора до неона. Таким образом, у неона заполненными оказываются первая и вторая оболочки. В третьем периоде заполняется третья оболочка, которая может содержать три уровня - s, р и d.
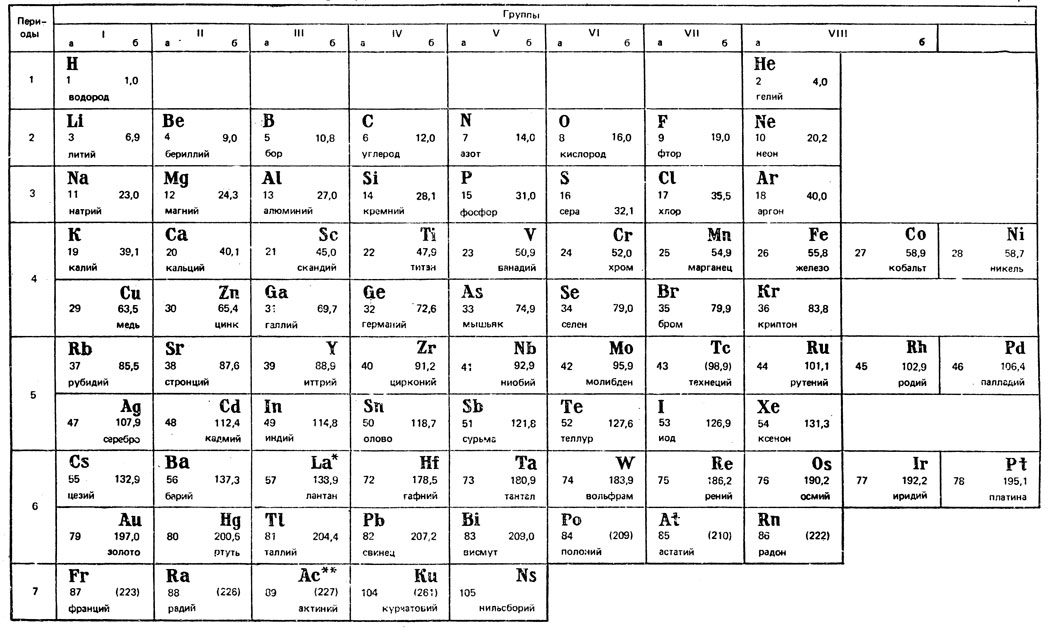
Периодическая система элементов Д. И. Менделеева
У аргона оказываются заполненными 3s- и 3р-уровни, однако у элементов следующего периода - калия и кальция - заполняется не 3d-уровень, а 4 s. Из рис. 1 следует, что заполнение 4 s-, а не 3d-уровня энергетически более выгодно, так как энергия s-электронов четвертой оболочки ниже энергии d-электронов третьей оболочки.
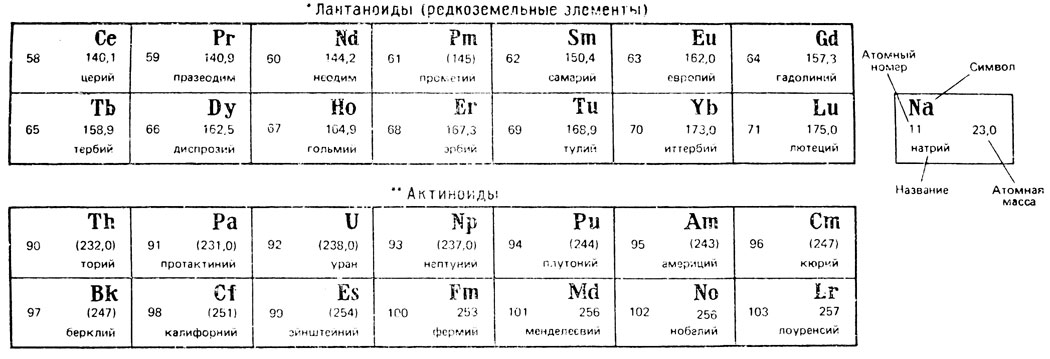
Лантаноиды (редкоземельные элементы)
У элементов со скандия по натрий заполняется 3d-уровень при заполненном 4s-уровне. Так, электронное строение скандия можно записать в виде ls22s22p63s23p63d14s2. Такие металлы с недостроенными внутренними уровнями называются переходными металлами. Металлы с недостроенными d-уровнями иногда называют d-металлами. К ним относятся металлы от скандия до никеля, от иттрия до палладия, лантан и далее от гафния до платины (см. табл. 1). Так называемые редкоземельные металлы (от церия до лютеция) также являются переходными, но у них достраивается 4 f-уровень при заполненном внешнем 6 s-уровне.
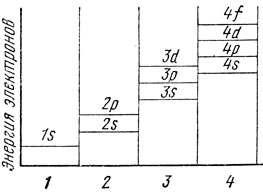
Рис. 1. Энергия электронов, принадлежащих разным уровням и оболочкам
Выше шла речь об одиночных атомах, находящихся на больших расстояниях один от другого. В твердом веществе атомы размещены на столь близких расстояниях, что взаимодействуют между собой. Это в первую очередь выражается во взаимодействии электронов, обладающих наибольшей энергией и называемых валентными электронами. В результате такого взаимодействия меняются энергия и распределение в пространстве валентных электронов, а сами атомы размещаются один относительно другого в определенном порядке.
В твердом веществе, состоящем из огромного числа атомов, электроны одного уровня имеют не строго одинаковую энергию, как это было в одиночном атоме, а целый ряд значений энергий в определенных пределах. Таким образом, в твердом веществе происходит как бы расщепление энергетических уровней на громадное число подуровней, составляющих энергетическую зону. Однако число электронов, могущих располагаться в каждой энергетической зоне, ограничено теми же правилами квантовой механики, что и в случае одиночного атома. Поэтому могут быть заполненные и незаполненные энергетические зоны.
Появление энергетических зон приводит к тому, что в некоторых случаях значения энергий электронов, принадлежащих к разным уровням в атомах, сближаются вплоть до совпадения в определенных пределах. Это явление называется перекрытием энергетических зон. В таких случаях электроны могут беспрепятственно переходить из одной зоны в другую. В других случаях зоны отделены одна от другой значительным энергетическим промежутком, который называется запрещенной зоной. В таких случаях переход электронов из нижней зоны (валентной) с малой энергией в верхнюю (зону проводимости) с большой энергией затруднен. Это затруднение тем больше, чем больше ширина (величина) запрещенной зоны.
Большое число химических элементов имеет атомы с незначительно застроенными последними электронными, оболочками. Поэтому в твердом состоянии у этих элементов часть валентных электронов легко переходит на более высокие энергетические подуровни и как бы отрывается от "родных" атомов, которые превращаются при этом в положительно заряженные ионы. Оказавшиеся свободными электроны в твердом веществе называют электронным газом. Такие электроны коллективно "обслуживают" всю упорядоченно расположенную систему ионов, при этом общая система ионов и электронов остается электрически нейтральной. Такое взаимодействие между атомами называют металлической связью, а соответствующие химические элементы - металлами. Из всех известных в настоящее время химических элементов более 85% являются металлами (см. табл. 1).
Атомы химических элементов, обладающие в значительной мере заполненными электронными оболочками, могут взаимодействовать между собой иным образом. Между подобными атомами образуются пары из валентных электронов по одному от каждого атома, и эти пары "обслуживают" только два соседних атома. Таким образом, валентные электроны как бы закрепляются между соседними атомами. Подобная связь называется ковалентной.
Тип связи между атомами в значительной мере определяет такие свойства элемента, как температура плавления, теплопроводность, электропроводность. Элементы-металлы благодаря наличию свободных электронов имеют высокую проводимость или, иначе говоря, малое электросопротивление. Движение электронов в металлах затрудняется тепловыми колебаниями атомов (ионов). Поэтому электросопротивление чистых металлов растет с повышением температуры. При падении температуры до абсолютного нуля (0К), когда тепловые колебания делаются исчезающе малыми, электросопротивление металлов стремится к бесконечно малой величине. Присутствие в металле инородных атомов затрудняет движение электронов. Поэтому примеси и добавки вызывают существенное повышение электросопротивления металлов, и, наоборот, чем чище металл, тем ниже его сопротивление. Электросопротивление металла с намеренно введенными добавками, т. е. сплава, всегда больше, чем основного металла. Электросопротивление чистых металлов при 0°С составляет от 15,1 и 15,6 нОм·м у серебра и меди, до 910 и 1070 нОм·м у ртути и висмута (табл. 2).
Таблица 2. Структура и некоторые физические свойства элементов
| Элемент | Структура | Плотность при 20°С, г/см3 | Удельная теплоемкость при 20°С, кДж/кг·К | Теплопроводность (при температуре, °С), Вт/(м·К) | Удельное электросопротивление (при температуре, °С), нОм·м | Температура, °С | |
| плавления | кипения | ||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Алюминий | Г. ц. к. | 2,7 | 0,9 | 245 (-100), 238 (0), 226 (300) | 3 (-195), 24,5 (0), 59 (300) | 660 | 2330 |
| Берилий | Г. п. у. | 1,85 | 1,8 | 410 (-100), 230 (0), 90 (700) | 29 (0), 26 (700) | 1280 | 2500 |
| Бор | Тетрагон | 2,34 | 1,3 | 170 (20) | 4·1017 (-100), 2·1013 (0), 1·107 (500) | 2200 | ∼2550 |
| Ванадий | О. ц. к. | 6,1 | 0,5 | 31 (100), 32 (700) | 26 (-195), 182 (0), 554 (600) | 1900 | ∼3300 |
| Висмут | Ромбоэдр. | 9,8 | 0,12 | 8,5 (20), 7,5 (250) | 350 (-195), 1070 (0), 1560 (100) | 271 | 1630 |
| Вольфрам | О. ц. к. | 19,3 | 0,13 | 190 (0), 113 (1000), 195 (2000) | 55 (20), 500 (1500), 1000 (3000) | 3400 | 5900 |
| Галлий | Ромбич. | 5,9 | 0,33 | - | 530 (20) | 29,8 | 1980 |
| Гафний | Г. п. у. (до 1700 °С); О. ц. к. (выше 1700°С) | 13,3 | 0,15 | 22 (50)20 (500) | 300 (0), 100 (600) | 2220 | 5400 |
| Германий | Алмазн. куб | 5,32 | 0,36 | 61 (20) | 1·106 - 1·108 (0), 1,6·104 (600) | 937 | 2700 |
| Железо | О. ц. к. (до 910 и выше 1390°С), г. ц. к. (910 - 1390°С) | 7,87 | 0,44 | 94 (-100), 81 (0), 34 (700) | 7 (-195), 89 (0), 1220 (1200) | 1536 | 3000 |
| Золото | Г. ц. к. | 19,3 | 0,13 | 330 (-100), 310 (0) | 20,4 (0), 28 (100) | 1063 | 2600 |
| Индий | Объемноцентр. тетрагон. | 7,31 | 0,24 | 24 (50) | 18 (-195), 84 (0) | 157 | 2075 |
| Иод | Ромбич. | 4,9 | 0,2 | 0,4 (20) | 1·106 (20) | 114 | 183* |
| Иттрий | Г. п. у. (до 1400°С) | 4,48 | 0,31 | 80 (20) | 530 (20), 1910 (1000) | 1520 | ∼3000 |
| Кадмий | Г. п. у. | 8,65 | 0,23 | 92 (0), 90 (100) | 16 (-195), 68 (0) | 321 | 765 |
| Калий | О. ц. к. | 0,86 | 0,74 | 99 (0) | 14 (-195) 31 (0) | 63,6 | 775 |
| Кальций | Г. п. у. (до 450°С), о. ц. к. (выше 450°С) | 1,55 | 0,65 | 120 (0) | 43 (20) | 850 | 1482 |
| Кобальт | Г. п. у. (до 400°С), г. ц. к. (выше 400°С) | 8,95 | 0,4 | 69 (0) | 57 (0) | 1495 | ∼3000 |
| Кремний | Алмазн. куб. | 2,32 | 0,64 | 81 (0) | 2·1011 (20), 1·104 (500) | 1423 | 2600 |
| Лантан | Г. п. у. (до 330°С), г. ц. к. (выше 330°С) | 6,16 | 0,20 | 12 (25) | 570 (25) | 920 | 3400 |
| Литий | О. ц. к. | 0,53 | 3,28 | 71 (0) | 86 (0), 127 (100) | 180 | 1370 |
| Магний | Г. п. у. | 1,74 | 1,02 | 160 (-100), 150 (0) | 6 (-195), 39 (0) | 644 | 1103 |
| Марганец | Сложная куб. (до 727°С), о. ц. к. (выше 1130°С) | 7,44 | 0,45 | - | 2580 (0), 3070 (700) | 1243 | 2100 |
| Титан | Г. п. у. (до 882°С), о. ц. к. (выше 882°С) | 4,51 | 0,5 | 17 (20) | 160 (-195), 500 (0) | 1670 | 3260 |
| Углерод: алмаз | Алмазн. куб. | 3,5 | 0,45 | 140 (0) | 1·1021 (0) | - | - |
| графит | Гексагон. | 2,2 | 0,70 | 24 (0) | (3,5 - 63)·103 (0) | - | 3500* |
| Уран | Ромбич. (до 660°С), тетрагон. (660 - 775°С), о. ц. к. (выше °С) | 19,05 | 0,12 | 29 (70) | 290 (20), 560 (700) | 1133 | 3900 |
| Фосфор (белый) | Куб. | 1,85 | 0,74 | - | 1·1018 (0) | 44 | 280 |
| Хром | О. ц. к. | 7,19 | 0,46 | 67 (20) | 5 (-195), 127 (0), 802 (700) | 1845 | 2500 |
| Церий | О. ц. к. (выше 730°С) | 6,8 | 0,17 | - | 730 (0), 1100 (700) | 804 | 3600 |
| Цинк | Г. п. у. | 7,14 | 0,39 | 113 (0), 100 (300) | 55 (0), 130 (300) | 419,5 | 907 |
| Цирконий | Г. п. у. (до 865°С), о. ц. к. (выше 865°С) | 6,49 | 0,29 | 21 (0), 19 (300) | 73 (-195), 400 (0), 1100 (1000) | 1855 | 3580 |
Примечания: 1. о. ц. к. - объемноцентрированная кубическая; г. ц. к. - гренецентрированная кубическая; г. п. у. - гексагональная плотноупакованная.
2. нОм·м = 10-9 Ом·м.
*(Температура возгона.)
У элементов с ковалентной связью между атомами валентные электроны обобществлены попарно между соседними атомами. Поэтому при невысоких температурах электросопротивление таких элементов намного выше, чем у элементов с металлической связью. Эти элементы характеризуются высокими значениями ширины запрещенной зоны, разделяющей валентную зону и зону проводимости.
По ширине запрещенной зоны твердые вещества - неметаллы подразделяются на изоляторы и полупроводники. Ширина запрещенной зоны измеряется тем приростом энергии, который должен получить валентный электрон, чтобы перейти в зону проводимости.
К изоляторам относят вещества с шириной запрещенной зоны более 5 эВ. Это достаточно большая величина, так что у изоляторов количество электронов, переходящих в зону проводимости, очень невелико. К полупроводникам относят вещества с шириной запрещенной зоны в пределах 0,01 - 5 эВ.
Типичными изоляторами являются такие металлоиды, как сера и фосфор. Их электросопротивление при 0°С составляет от 109 до 1015 Ом·м. Типичные полупроводники - селен, бор, теллур, германий, кремний. Наиболее ярко полупроводниковые свойства выражены у германия и кремния. Если эти элементы содержат очень малое количество примесей, их сопротивление имеет величину порядка 0,001 - 100 Ом·м. Иначе говоря, их электропроводность, которую в этом случае называют собственной проводимостью, весьма мала. В таком состоянии электрический ток осуществляется не только за счет электронов, достигших определенного уровня энергии, но и за счет так называемых "дырок", т. е. незаполненных энергетических уровней, появившихся после перехода части электронов в более высокоэнергетическое состояние. Эти дырки могут рассматриваться как носители положительных электрических зарядов, движущиеся к отрицательному полюсу.
Электроны в полупроводнике, способные перемещаться к положительному полюсу, называются электронами проводимости. Их количество в сравнении с общим числом валентных электронов, осуществляющих ковалентную связь между атомами, очень невелико и не превышает долей процента. Именно поэтому электрическое сопротивление полупроводников всегда во много раз больше, чем металлов.
Повышение температуры, как и в случае металлов, вызывает усиление тепловых колебаний атомов, однако одновременно в полупроводниках повышение температуры способствует дополнительному переходу валентных электронов из ковалентных пар на более высокие энергетические уровни и поэтому в общем итоге электрическое сопротивление полупроводников при повышении температуры уменьшается. В этом заключается одно из главных отличий полупроводников от металлов.
Хотя повышение температуры вызывает весьма значительное падение электросопротивления, значение этого свойства у полупроводников остается несравненно более высоким, чем у металлов. Так, если у меди при 700°С электросопротивление равно 67 нОм·м, то у кремния и германия оно составляет около 10-5 Ом·м (см. табл. 2), хотя у этих элементов электросопротивление снижается по сравнению со значениями при комнатной температуре в 104 - 107 раз. Собственная проводимость полупроводников увеличивается не только под действием нагрева. Облучение светом также повышает энергию валентных электронов, часть их переходит в зону проводимости, и электрическое сопротивление полупроводника существенно снижается.
Кроме собственной проводимости, в полупроводниках наблюдается еще и примесная проводимость. Она появляется благодаря присутствию в полупроводнике атомов некоторых примесей. Если, например, в кремнии имеется примесь сурьмы или другого элемента пятой группы таблицы Д. И. Менделеева, то происходит следующее явление. Атом сурьмы имеет пять валентных электронов, четыре из них образуют ковалентные связи с соседними атомами кремния, а пятый электрон очень легко переходит в зону проводимости. Таким образом, получается полупроводник (кремний) n-типа с электронной проводимостью. Название "n-тип" произошло от английского слова negative - отрицательный. Добавки, подобные сурьме, создающие электроны проводимости в полупроводниках, называются донорами. Электрический ток в полупроводниках n-типа осуществляется только электронами доноров, поскольку их в 105 - 107 раз больше, чем собственных носителей зарядов полупроводника.
Если в кремний внесено незначительное количество атомов какого-либо элемента третьей группы таблицы Д. И. Менделеева, например алюминия, то около каждого атома возникает положительно заряженная дырка из-за нехватки одного электрона для образования связей с четырьмя соседними атомами кремния. Такой кремний обладает дырочной проводимостью и называется полупроводником р-типа. Название произошло от английского слова positive - положительный. Добавки, подобные алюминию, называют акцепторами.
Проводимость полупроводника, содержащего доноры или акцепторы, всегда больше, чем собственная проводимость. Иначе говоря, в полупроводниках некоторые примеси в малом количестве способны очень сильно (в 103 - 104 раз) понизить электросопротивление. В этом состоит другое главнейшее отличие полупроводников от металлов, у которых электросопротивление всегда возрастает от добавок любых элементов.
Большая теплопроводность металлов объясняется также наличием свободных электронов. Передача тепловой энергии в металлах осуществляется двояким образом: колебательным движением ионов и движением свободных электронов. Поэтому теплопроводность металлов существенно выше, чем неметаллов и полупроводников, в которых теплопередача происходит только путем колебательного движения атомов (см. табл. 2). Однако разница здесь не столь велика, как в случае электросопротивления.
Одно из наиболее очевидных отличительных свойств металлов заключается в том, что они под действием внешних механических нагрузок способны изменять свою форму не разрушаясь, т. е. они способны пластически деформироваться. Способность к пластическому деформированию объясняется опять-таки существованием в металлах свободных электронов, которые обеспечивают целостность объема металла, даже если одна часть этого объема смещается относительно другой. В веществах с иными видами связи смещение соседних частей объема вызывает разрыв связей между соседними атомами или ионами. Поэтому такие вещества при воздействии внешних нагрузок при комнатной температуре обычно разрушаются хрупко, без заметной пластической деформации.
Выше разбирались случаи существования только металлической или только ковалентной связи. Однако во многих кристаллических веществах связь между частицами не проявляется в чистом виде. Так, в кристаллах полупроводникового теллура и металлических висмута и сурьмы существует смешанная связь - частично металлическая и частично ковалентная.
Кроме того, в кристаллах элементов может наблюдаться еще один вид связи, обусловленный силами Ван-дер-Ваальса. Эта связь возникает в результате электростатического притяжения частиц, у которых при сближении образуются участки с устойчивыми разноименными электрическими зарядами. Такая связь обычно действует между молекулами кристаллических веществ. Например, силы Ван-дер-Ваальса удерживают двухатомные молекулы йода в кристаллах этого элемента, а между двумя атомами в молекуле действует ковалентная связь. Силы Ван-дер-Ваальса во много раз слабее тех сил, которые определяют ковалентную и металлическую связи, поэтому кристаллы со связями Ван-дер-Ваальса между частицами обычно обладают малой прочностью, низкой температурой плавления и кипения (или возгонки). Связь Ван-дер-Ваальса характерна для многих органических соединений.
Существует еще один тип связи между атомами - ионная или гетерополярная связь. Она возникает между атомами разных видов, т. е. между атомами разных элементов, например, между атомами металла и металлоида. Взаимодействие между такими разнородными атомами выражается в том, что валентные электроны от атомов металла переходят на внешние оболочки атомов металлоида. Образующиеся в результате этого положительные и отрицательные ионы располагаются в пространстве так, что силы притягивания и отталкивания уравновешиваются.
|
ПОИСК:
|
© METALLURGU.RU, 2010-2020
При использовании материалов сайта активная ссылка обязательна:
http://metallurgu.ru/ 'Библиотека по металлургии'
При использовании материалов сайта активная ссылка обязательна:
http://metallurgu.ru/ 'Библиотека по металлургии'