
2. Фотоколориметрический метод определения железа в виде сульфосалицилатного комплекса
В металлах и сплавах на медной основе, не содержащих олова
Сущность метода. Трехвалентное железо с сульфосалициловой кислотой.
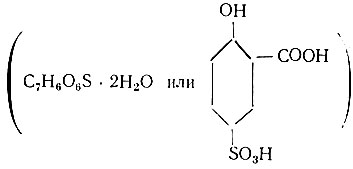
при рН = 8÷11,5 образует окрашенное в желтый цвет комплексное соединение.
Определению мешают медь, образующая окрашенный комплекс с сульфосалициловой кислотой, окрашенные ионы никеля и другие элементы. Железо от мешающих элементов отделяют аммиаком в присутствии коллектора - солей алюминия.
Выполнение определения. Анализ проводят так же, как описано в методе определения железа с ортофенантролином, до растворения осадка гидроокисей.
Полученный солянокислый раствор переносят в мерную колбу емкостью 250 см3, разбавляют водой до метки и перемешивают.
Берут аликвотную часть, 50 см3, переносят в мерную колбу емкостью 100 см3, прибавляют 30 см3 раствора сульфосалицилата натрия (100 г/л), аммиак (плотность 900 кг/м3) по каплям, до образования устойчивой желтой окраски, и 1 см3 его в избыток. Разбавляют водой до метки, перемешивают и фотометрируют в кювете при толщине слоя 20 мм с синим светофильтром (длина волны 420-430 нм).
В качестве эталона сравнения применяют стандартный раствор железа, прибавляя его к холостой пробе, проведенной через все стадии анализа. Нуль прибора устанавливают по воде.
Процентное содержание железа вычисляют по формуле (54).
В металлическом олове
Сущность метода. Навеску образца растворяют в соляной кислоте в присутствии перекиси водорода. Медь отделяют серноватистокислым натрием.
Остальные мешающие компоненты, в том числе и олово, переводят в растворимые лимоннокислые комплексы.
Реактивы. 1. Стандартный раствор железа: 0,43 г железоаммонийных квасцов растворяют в 1 л соляной кислоты (1:10) 1 см3 раствор содержит 0,05 мг железа.
Выполнение определения. Навеску 0,5 г образца помещают в стакан емкостью 100-150 см3, прибавляют 10 см3 соляной кислоты, несколько капель 5%-ной перекиси водорода и нагревают до полного растворения под стеклом. Разбавляют раствор водой до объема 35-40 см3, нагревают до кипения и к кипящему раствору приливают 10 см3 раствора серноватистокислого натрия (30 г/л). Раствор кипятят до коагуляции осадка, отфильтровывают на быстрофильтрующий фильтр и промывают 3-4 раза разбавленной соляной кислотой (1:10).
Фильтрат напревают до кипения и прибавляют 5 капель перекиси водорода. Появляющаяся при этом муть исчезает при дальнейшем кипячении, в противном случае добавляют еще 1-2 капли перекиси водорода.
Раствор должен содержать небольшой избыток перекиси водорода, чтобы полностью разрушить серноватистокислый натрий и окислить олово до четырехвалентного.
Избыток перекиси водорода удаляют кипячением в течение 10-15 мин. По охлаждении добавляют 5 г лимонной кислоты и аммиака, разбавленного 2:1 до щелочной реакции по лакмусу, и 7 см3 в избыток. Переносят раствор в мерную колбу емкостью 50 или 100 см3 (в зависимости от интенсивности окрашивания), добавляют 25 см3 раствора сульфосалицилового натрия (100 г/л), разбавляют водой до метки, перемешивают и фотометрируют с синим светофильтром.
В металлической сурьме
Сущность метода. Навеску образца растворяют в соляной кислоте в присутствии перекиси водорода. Влияние сопутствующих элементов устраняют добавлением виннокаменной кислоты.
Выполнение определения. Навеску 0,1 г образца помещают в мерную колбу емкостью 50 см3, прибавляют 10 см3 соляной кислоты (плотность 1190 кг/м3), 0,5 см3 перекиси водорода и растворяют при нагревании.
К раствору прибавляют 1 см3 раствора винной кислоты (400 г/л) и заканчивают определение, как описано в методе определения железа с сульфосалициловым натрием.
|
ПОИСК:
|
© METALLURGU.RU, 2010-2020
При использовании материалов сайта активная ссылка обязательна:
http://metallurgu.ru/ 'Библиотека по металлургии'
При использовании материалов сайта активная ссылка обязательна:
http://metallurgu.ru/ 'Библиотека по металлургии'