
Потенциометрический метод анализа
Потенциометрический метод анализа основан на измерении потенциалов электродов, погруженных в титруемый раствор.
Если в объемном методе анализа для обнаружения конца титрования пользуются различными индикаторами, то в потенциометрическом методе эквивалентную точку определяют при помощи "скачка потенциала" индикаторного электрода.
Потенциал индикаторного электрода определяется известным уравнением Нернста и находится в прямой зависимости от логарифма концентрации определяемого иона.
В окислительно-восстановительных реакциях потенциал индикаторного электрода пропорционален логарифму отношения концентрации окисленной формы к концентрации восстановленной формы.
Во многих случаях окислительно-восстановительных реакций потенциал индикаторного электрода зависит не только от концентрации окисленной и восстановленной формы, но и от концентрации ионов водорода, причем чем больше концентрация ионов водорода, тем больше и скачок потенциала в эквивалентной точке. Вот почему для увеличения скачка потенциала при потенциометрическом методе определения хрома в титруемый раствор дополнительно вводят серную кислоту.
В потенциометрическом методе анализа титрование производится с двумя электродами. Электрод, который реагирует на изменение концентрации определяемого иона в растворе, называется индикаторным. Другой электрод является индиферентным по отношению к титруемым ионам. Он служит только для определения потенциала индикаторного электрода и называется электродом сравнения. Наиболее распространенным электродом сравнения является каломельный электрод. Каломельный электрод состоит из небольшого количества ртути, покрытой тонким слоем твердой каломели и погруженной в раствор хлорида калия, который может быть 0,1-н., 1-н. или насыщенным.
В потенциометрическом титровании используются окислительно-восстановительные реакции, реакции осаждения и комплексообразования, а также изменение в результате реакции рН раствора.
Индикаторный электрод выбирают в каждом отдельном случае в соответствии с типом реакции, лежащей в основе потенцио-метрического титрования.
Любой металлический электрод, находящийся в равновесии со своими ионами, будет принимать потенциал, зависящий от концентрации ионов этого металла в растворе. Однако в обычных условиях многие металлические электроды покрываются на воздухе пассивирующей окисной пленкой и не реагируют на концентрацию своих ионов. К таким металлам относятся все металлы, более активные, чем водород. Кроме того, металлические электроды нельзя применять, если в растворе находятся ионы более благородного металла, чем металл индикаторного электрода.
Например, алюминиевый электрод не пригоден в качестве индикаторного, если в испытуемом растворе, кроме алюминия, присутствуют ионы меди. В этом случае медь осаждается на алюминиевом электроде и электрод становится нечувствительным.
В потенциометрическом титровании, основанном на окислительно-восстановительных процессах, в качестве индикаторного электрода применяется платиновый электрод. Скачок потенциала в эквивалентной точке в этом случае является следствием изменения соотношения окисленной и восстановленной формы вещества.
Например, в потенциометрическом методе определения марганца, предложенном в 1946 г. Лингейном и Карплус и разработанным у нас в ССCP Бусевым и Дмитриевой, ионы двухвалентного марганца окисляются марганцевокислым калием до трехвалентной формы и связываются при этом в пирофосфатный комплекс. Реакция протекает в нейтральной или слабокислой среде. Небольшой избыток марганцевокислого калия изменяет потенциал платинового электрода и стрелка гальванометра отмечает скачок.
Метод позволяет определять марганец с большой точностью на фоне многих компонентов в высоколегированной стали. Мешает лишь присутствие ванадия, начиная с 1% и выше. Платиновый электрод в качестве индикаторного применяется при потенциометрическом определении хрома и ванадия.
Оба метода основаны на окислении хрома и ванадия надсернокислым аммонием с последующим их восстановлением раствором двойной сернокислой соли закиси железа-аммония.
Потенциометрический метод может быть применен ко многим реакциям осаждения и комплексообразования с использованием подходящей электродной пары.
В качестве электродов применяют, например, серебро и ртуть. Так, определение никеля титрованием цианистым калием производят, с серебряным электродом.
Применяются также электроды, покрытые труднорастворимой солью того же металла. Например, хлористосеребряные, бромистосеребряные, йодистосеребряные и сернистосеребряные электроды. Очень часто при реакциях осаждения и комплексообразования применяют платиновый электрод. В этом случае вводят дополнительно окислительно-восстановительную систему. При потенциометрическом методе определения свинца в бронзах, основанном на титровании ионов свинца раствором ферроцианида калия с образованием малорастворимого аморфного белого осадка ферроцианида свинца, в качестве электродов применяются платина - насыщенный каломельный электрод.
Потенциал платинового электрода зависит от соотношения количеств ферроцианида калия и феррицианида калия. Поэтому перед титрованием добавляется несколько капель раствора феррицианида калия. При этом цинк и медь должны отсутствовать, так как они образуют осадки. Цинк и медь предварительно отделяют.
Потенциометрический метод определения кобальта основан на титровании его раствором феррицианида калия в аммиачной среде с парой электродов платина - насыщенный каломельный электрод или платина - вольфрам. Определению кобальта мешает присутствие в растворе ионов марганца, так как последний также титруется раствором феррицианида калия. При расчете содержания кобальта вводят поправку на марганец или последний предварительно отделяют.
Во многих случаях потенциометрического титрования, основанных как на окислительно-восстановительных процессах, так и на процессах комплексообразования, электродная пара платина - насыщенный каломельный электрод может с успехом заменяться биметаллической парой электродов платина - вольфрам, которая более удобна в обращении в условиях заводской лаборатории.
С биметаллической парой электродов можно определять цинк и кадмий в магниевых и алюминиевых сплавах и проводить другие определения.
Метод определения алюминия, предложенный. С. К. Чирковым основан на титровании алюминия раствором фторида натрия с образованием хорошо растворимого в воде малодиссоциированного фторида алюминия. В пределах рН раствора 3,2-4,5 реакция идет по уравнению
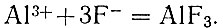
В качестве индикаторного электрода, чувствительного к ионам фтора, оказался единственный металлический электрод - алюминиевый.
Механизм взаимодействия индикаторного алюминиевого электрода заключается в следующем: алюминиевый электрод на воздухе покрывается тонкой окисной пленкой Al2O3. В эквивалентной точке избыток ионов фтора растворяет окисную пленку, алюминиевый электрод обнажается и начинает посылать свои ионы в раствор, потенциал его падает и стрелка гальванометра отклоняется.
В качестве электрода сравнения при определении алюминия применяют насыщенный каломельный, серебряный, нихромовый и цинковый.
Электродную пару алюминий - цинк удобнее применять в том отношении, что титрование производится до выравнивания потенциалов электродов, т. е. до нулевой точки гальванометра, без построения кривой титрования.
Определению алюминия мешают железо и медь. Трехвалентное железо также образует комплекс с ионами фтора - FeF3, a медь в виде металлической осаждается на алюминиевом электроде и последний становится нечувствительным к ионам фтора. Мешающее действие меди и железа устраняют восстановлением их металлическим цинком.
Большой интерес представляет потенциометрический метод определения углерода. Этот метод был разработан чешским ученым Кысил. Принцип метода заключается в следующем: пробу образца сжигают при 1200-1350°С в токе кислорода. Выделяющуюся двуокись углерода поглощают щелочным раствором хлористого бария, в который погружена пара электродов платина - насыщенный каломельный электрод. При поглощении двуокиси углерода изменяется рН раствора, а следовательно, и потенциал индикаторного электрода, и стрелка гальванометра отклоняется. Путем титрования щелочным раствором хлористого бария стрелку гальванометра возвращают в исходное положение. По количеству израсходованного на титрование щелочного раствора хлористого бария рассчитывают процентное содержание углерода. Метод позволяет определять углерод с высокой точностью при содержании в тысячных долях процента.
Изготовление электродов
Алюминиевый электрод изготовляют из алюминиевой проволоки. Нижний конец электрода закругляют напильником. Поверхность электрода полируют до блеска мелкой бархатной шкуркой и затем протирают влажной фильтровальной бумагой. Зачищают электрод перед каждым титрованием.
Серебряный электрод изготовляют припаиванием серебряной проволоки к медной.
Цинковый электрод готовят расплавлением металлического цинка. Полученный слиток обрабатывают до получения формы стержня. Конец стержня закругляют напильником и припаивают другим концом к медной проволоке.
Платиновый электрод готовят следующим образом: платиновую проволочку толщиной 0,8-1 мм и длиной 10 мм, к которой предварительно припаяна медная проволока, впаивают в стеклянную трубочку. К концу проволочки припаивают кусочек платиновой фольги.
Вольфрамовый электрод. В медную муфточку с помощью кусочка расплавленного олова впаивают вольфрамовую проволоку длиной 3-4 см. К другому концу медной муфточки припаивают медную проволоку.
Насыщенный каломельный электрод. На дно сосуда помещают чистую ртуть и прибавляют немного пасты, которую готовят следующим образом: к капле ртути прибавляют на кончике ножа каломели и несколько капель насыщенного раствора КСl и растирают в агатовой ступке до однородной массы. Затем на водяной бане готовят насыщенный раствор хлористого калия с агар-агаром следующим образом: к 100 см3 воды прибавляют 3 г агар-агара, по растворении его вносят 40 г KCl, доводят раствор до кипения и заливают в сосуд таким образом,, чтобы носик сосуда был заполнен без пузырьков. При хранении носик сосуда должен всегда находиться в насыщенном растворе хлористого калия. Более правильно было бы заполнить сосуд насыщенным раствором хлористого калия, без добавления агар-агара, а добавлять его только в мостик, соединяющий каломельный электрод с титруемым раствором. Но для потенциометрического титрования, где фиксируется относительное изменение потенциала электрода, это обстоятельство несущественно.
Потенциометрическое титрование производят двумя методами: компенсационным и некомпенсационным.
Классическим методом измерения разности потенциалов является компенсационный метод Поггендорфа, который хорошо описай в учебниках электрохимии. Метод заключается в том, что неизвестная разность потенциалов компенсируется противоположно направленной известной разностью потенциалов.
Для проведения компенсационного титрования пользуются потенциометрами. Преимущество потенциометра заключается в том, что при измерении электродвижущей силы элемента ток практически не расходуется. Поэтому определяемые значения э. д. с. не имеют ошибок, связанных с сопротивлением элемента или его поляризацией. На практике для измерения разности потенциалов широкое распространение получил лабораторный потенциометр ППТВ-1 (рис. 3). Измеряемая э. д. с. на этом потенциометре уравновешивается падением напряжения на группе точных сопротивлений, по которым протекает ток строго определенной величины. Этот прибор может быть использован для определения хрома и ванадия потенциометрическим методом, так как титрование по некомпенсационной схеме проводить не рекомендуется вследствие небольшого скачка потенциала в эквивалентной точке.

Рис. 3. Потенциометр ППТВ-1
Некомпенсационный метод более прост, быстро выполним и удобен в аппаратурном оформлении по сравнению с компенсационным методом. В некомпенсационном методе титрования два различных электрода (индикаторный и электрод сравнения) замыкаются через сравнительно небольшое внешнее сопротивление и гальванометр или милливольтметр (рис. 4). В этих условиях один электрод поляризуется положительно (анодно), а другой отрицательно (катодно). В эквивалентной точке в присутствии свободных ионов титрующего раствора увеличивается разность потенциалов электродов и, следовательно, сила поляризационного тока. При некомпенсационном методе титрования эквивалентная точка отмечается по резкому возрастанию силы поляризационного тока, протекающего между электродами.
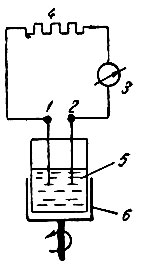
Рис. 4. Схема некомпенсационного метода титрования: 1, 2 - электроды; 3 - гальванометр; 4 - внешнее сопротивление; 5 - титруемый раствор; 6 - вращающийся столик
Биметаллическая пара электродов погружается в титруемый раствор совместно с неподвижной мешалкой. Электроды соединяются с гальванометром последовательно через сопротивления. В качестве сопротивления применяется магазин сопротивлений на 50-100 тыс. ом типа КМС-6 или сопротивления Каминского. Обычно требуется сопротивление 5000-25000 ом. В качестве измерительного прибора применяется стрелочный гальванометр со шкалой на 17 мв и внутренним сопротивлением 200-400 ом. При некомпенсационном методе титрования перемешивание раствора осуществляется вращением стакана с раствором с помощью моторчика, снабженного столиком с держателем для стакана. Число оборотов столика составляет 180 об/мин.
Если изменение разности потенциалов в эквивалентной точке мало, то титрование рекомендуется проводить на ламповом потенциометре.
Действие лампового потенциометра заключается в следующем: на катод и сетку катодной лампы накладывается напряжение от электродной пары.
Изменение разности потенциалов электродной пары в эквивалентной точке изменяет потенциал сетки. Изменение потенциала сетки вызывает резкое увеличение анодного тока, в цепь которого включен гальванометр, проградуированный в мв. Так как лампа имеет очень большое сопротивление, порядка нескольких мегаом, то через электроды, замкнутые на лампу, практически протекает очень малый ток, т. е. электроды не поляризуются. В этом случае, как и в компенсационном методе, измеряется разность потенциалов электродов.
Потенциометрический метод анализа может быть с успехом применен и для определения следовых количеств элементов порядка 10-4-10-5% при наличии прецизионных потенциометров и микробюреток на 0,1-0,2 см3 с ценой деления 0,005 см3 Объем титруемого раствора должен составлять не более 5,0-10,0 см3
|
ПОИСК:
|
© METALLURGU.RU, 2010-2020
При использовании материалов сайта активная ссылка обязательна:
http://metallurgu.ru/ 'Библиотека по металлургии'
При использовании материалов сайта активная ссылка обязательна:
http://metallurgu.ru/ 'Библиотека по металлургии'