
Глава XI. "Нечисть" в семье металлов (Никель и кобальт)
Старый Ник, насмешливый и любопытный гном, тогда еще проживавший в Саксонии, любил поддразнивать горняков и нередко подсовывал им вместо полноценной руды похожий на нее минерал, из которого не удавалось выплавить ни меди, ни металла вообще.

Так уж устроено в природе: если близки свойства химических элементов, то похожи и их природные соединения - минералы. Зачастую и встречаются они вместе, в одних и тех же рудах. Сходство ближайших родственников железа - кобальта и никеля-удивительным образом начинается с имени: Кобольд и Никель - прозвища горных гномов. Кобольд, или Кобальт*,- гном, поселившийся в Рудных горах, приспособился воровать серебро прямо из руды, превращая добрую серебряную руду в бесполезную и даже "вредную", ее так и звали кобальт. А Ник, Никель - имя другого шкодливого гнома, особенно охотно портившего медные руды.
* (Имя Кобольд из собственного превратилось в нарицательное: горных гномов называют кобольды.)
Эти негодные руды горняки прозвали купферникель, т. е. никелера медь, что звучало бранью - чертова медь. На вид скверный "кобальт" так же мало отличался от серебряной руды, как и "купферникель" от хорошей медной; но стоило лишь этим бесовским камням попасть в плавку, как поднимался страшенный чесночный смрад. Вся плавка шла насмарку! Подмастерья и мастера разбегались, заранее зная, что прока все равно не будет: металла не выплавишь, только отравишься, ведь "запах чеснока - признак мышьяка".
Вот так и вышло, что из всех элементов таблицы Менделеева как раз эта пара блестящих родственников железа, поселившихся впоследствии в соседних номерах таблицы (№ 27 и № 28), были названы именами озорных гномов Кобальта и Никеля. Именно из этих "испорченных зловредными гномами" руд были впервые получены новые металлы - кобальт и никель.
Но об этом чуть позже, а сейчас вернемся в XVI в., когда Никель и Кобальт слыли еще гномами, а о новых металлах и не слыхали... Зато в любом деле, где чуть что не ладилось, привыкли сваливать вину на нечистую силу, на колдовство. Тогда колдовство считалось в порядке вещей. Вспомните, именно за колдовство и ересь сожгли французскую героиню Столетней войны Жанну д'Арк и великого астронома Джордано Бруно. Серьезная опасность со стороны инквизиции грозила таким гигантам эпохи Возрождения, как Галилео Галилей, Мигель Сервантес. Бесчисленные безымянные для потомства "ведьмы" и "колдуны" веками - от раннего средневековья вплоть до XVI в.- полыхали в "очистительном" огне костров инквизиции.
И вот в это-то время, а точнее, в XVI в., возникло и осталось жить среди горняков предание о человеке, имевшем мужество увлечься "кобальтом"- рудой с безнадежно дурной репутацией.
Случилось это в Верхних Рудных горах, в Шнееберге. Горняцкое счастье словно оставило рудокопов, и народ стоном стонал от проделок Кобальта, похищавшего серебро прямо из руд. Как-то пришел в Шнееберг юноша по имени Кристоф Шюрер, сын аптекаря из Вестфалии. Скоро и дело ему нашлось на рудном дворе, потому что парень знал толк в химии. Спустя недолгое время полюбилась ему девушка Анна, дочь литейного мастера. И ей чужеземец пришелся по сердцу. Отец Анны дал согласие на свадьбу. Все, казалось бы, шло отлично. Уж и свадьбу назначили на ближайший праздник рудокопов. Но, пока Кристоф ждал радостного дня, беда подкарауливала его! А все из-за химии! Решил он употребить пресловутый кобальт на что-нибудь дельное. И вот в маленькой плавильне при руднике он тайно от всех стал ночами возиться с этой дурной рудой. Да так прилежно, ночь за ночью, опыт за опытом... Только рудничному люду в Шнееберге не понравилось такое дело. Решили люди, что пришлый парень верно алхимик, чернокнижник, а то и фальшивомонетчик! И вот постановили ночью захватить пришельца прямо на месте преступления. Собрался народ, рудный мастер, литейный мастер, подмастерья, присяжные, и пошли за Шюрером, чтобы арестовать его и судить. А суд над колдунами был тогда скорым! Поднялись на гору, в его тайную мастерскую, а Кристоф сам встретил их на пороге. Радостный, глаза сияют. Как удивился и испугался бедняга, когда на его руках защелкнули наручники, когда вокруг посыпались оскорбления и угрозы: "Вор! Колдун! Чернокнижник!" И все же Кристоф сумел сдержаться: "Люди! Остановитесь! Сперва взгляните, а потом судите! На счастье, я успел все кончить. И уверен, от моего дела польза будет и вам, и всей стране!" И с этими словами юноша показал целый чан великолепной ярко-синей краски тончайшего помола. Тут пришло время удивиться односельчанам. Теперь все хотели узнать секрет чудесной лазури. Кристоф все честно показал и объяснил. Рассказал, что удивительная синяя краска получается из руды, где, как считалось, и таится кобальт. Ну, разумеется, все были рады, и больше всех его невеста и ее отец - литейный мастер. Тяжкое обвинение сняли с юноши, в глазах всего народа он выглядел теперь героем.
Синий кобальт, принесший славу Кристофу Шюреру, поначалу так и звали "блаувундер" - синее чудо. Потом назвали его смальта (или шмальта). Легенда эта абсолютна достоверна: секрет получения синей кобальтовой краски из руд Шнееберга в Саксонии действительно был открыт в XVI в. Шюрером, как об этом повествует старинная легенда. Известно, что в Нюренберге рецепт Шюрера был приобретен голландскими купцами. Знаменитые голландские фаянсовые изразцы с синими корабликами и мельницами расписаны именно этим глубоким синим кобальтом.
Синие кобальтовые смальты появлялись, исчезали и вновь возникали неоднократно. Они были известны в Ассирии и в Древнем Египте. В Египте из них отливали священных жуков-скарабеев, почти не отличимых от вырезанных из драгоценного минерала лазурита. Потом секрет синей кобальтовой керамики и эмали был утерян. И знаменитый голубой "кобальтовый" фарфор ввозили из очень далекого в те времена Китая.
Вновь секрет синей окраски стекла и фарфора стал известен лишь в XIII в. в Венеции.
Венецианские дожи тайно переправили все стекольные мастерские на уединенный остров Мурано. Ведь кобальтово-синее венецианское стекло не имело тогда конкурентов на мировом рынке и стоило баснословно дорого, тем более что за этим великолепным стеклом числилась, помимо его красоты, репутация немедленно обнаруживать яд, если он подмешан в налитый в сосуд напиток,- свойство в средние века весьма актуальное. Тогда же был издан тайный указ, запрещавший стеклоделам под страхом смерти уезжать с острова Мурано, и, как известно из истории, этот приказ действовал не только на бумаге...
В 1520 г., за 20 лет до Шюрера, секрет синей краски был раскрыт в Германии. Но своей синей краски страна не получила: ее открыватель Вейдхаммер продал патент... в Венецию. И монополия дожей снова восторжествовала, на сей раз ценой подкупа.
Эти факты придают открытию Шюрера еще большую ценность. Но вот что любопытно: не все соли кобальта так стойко, веками, тысячелетиями, хранят свой глубокий синий цвет. Есть и другие кобальтовые краски. Их отличительная способность диаметрально противоположна: они меняют цвет на глазах.
В "Популярной библиотеке химических элементов", в очерке Б. И. Казакова о кобальте приводится такая иллюстрация этого свойства: "Профессор Базельского университета химик и врач Парацельс показывал написанную им самим картину. Она изображала зимний пейзаж - деревья и пригорки, покрытые снегом. Дав зрителям насмотреться, профессор слегка подогревал картину, и прямо на глазах у всех зимний ландшафт сменялся летним: деревья одевались листвой, на пригорках зеленела трава. Это производило впечатление чуда".
Для современного химика история с картиной Парацельса выглядит довольно просто. Такой эффект могли дать, в частности, кобальтовые краски. Раствор хлористого кобальта, к которому добавлено соответствующее количество хлористого никеля, почти бесцветен. Но при нагревании эти соли теряют кристаллизационную воду и цвет их меняется.
В 1737 г. один французский химик открыл свойство кобальтовых солей окрашиваться под действием тепла и использовал их в качестве симпатических чернил. Написанное ими на бумаге становится видимым только после того, как бумагу нагревают. Сейчас эта особенность солей кобальта имеет практическое значение в лабораторной технике: раствором кобальтовых солей метят фарфоровые тигли. После прогрева такая метка четко выступает на белой поверхности фарфора.
На Руси синяя кобальтовая краска называлась голубец.
Окрашивание стекла, фарфора, фаянса солями кобальта применяется и сейчас. Кто не видел кружек, кувшинов, занятных фигурок знаменитой Гжельской фабрики? Глубокий синий цвет узоров этих изделий - цвет солей кобальта. И такое вам, наверное, приходилось видеть: когда самолет идет на посадку, уже совсем у земли аэродром расцветает вдруг ярко-синими васильками сигнальных огней. Стекла сигнальных ламп также окрашены солями кобальта.
В виде самостоятельного химического элемента кобальт из саксонских руд был получен в 1735 г. знаменитым шведским химиком Георгом Брандтом. Это о нем сказал его еще более прославленный современник и соотечественник - естествоиспытатель Карл Линней: "Король может потерять свою армию,- но не пройдет и года, как он получит новую, нисколько не хуже. Король может потерять свой флот,- но не пройдет и двух лет, как будет снаряжен другой. Но другого Брандта королю не получить за все время пребывания на престоле".
"Я имел счастье быть первооткрывателем нового полуметалла, названного кобальт регулус..." - записал в дневнике Брандт (полуметаллами назывались в то время вещества, по внешнему виду подобные металлам, но не поддающиеся ковке; к ним относили тогда ртуть, висмут, цинк, сурьму).
Прошло всего несколько лет с момента его открытия, как на свет появился новый "полуметалл" и тоже из "бесовской" саксонской руды - металл никель. История его открытия весьма напоминает историю открытия кобальта.
Никель был открыт в 1751 г. молодым шведским металлургом Акселем Фредериком Кронстедтом, исследовавшим саксонский купферникель. "Купферникель - руда, которая содержит наибольшее количество... описанного полуметалла, поэтому я дал ему то же имя, или, для удобства, я назвал его никелем". И кобальт, и никель были признаны самостоятельными металлами далеко не сразу. Их открыватели так и не дождались полного торжества своих открытий. Долгое время и кобальт, и никель считали смесями ранее известных элементов: меди, железа, мышьяка, висмута. Их самостоятельность была доказана лишь в конце XVII в., но прозвища шкодливых саксонских гномов так и остались за ними.
Давайте сопоставим все удивительные совпадения: двум соседним металлам достаются имена гномов, так как оба встречаются в рудах, считавшихся "нечистью", оба при попытке расплавить их выделяют мышьяк. Нетрудно предположить, что за этими совпадениями стоит закономерность. Причем закономерность минералогическая. И никель, и кобальт охотно образуют природные со-единения - минералы с мышьяком. Такие минералы - арсениды никеля и кобальта - слагают особый тип руд. Они так и называются: мышьяково-никель-кобальтовые. Если прибавить, что к ним нередко приурочены и истинные минералы меди и серебра (часто и висмута) и что именно такое месторождение, как Шнееберг, было известно еще в средние века в Рудных горах, ситуация прояснится. Подобные As-Ni-Co месторождения вообще наиболее распространенные на земном шаре месторождения этих металлов, особенно кобальта. К ним, в частности, относится крупнейшее месторождение Северной Америки; оно так и названо Кобальт и расположено в Канаде, в районе Великих озер.
Каковы же собой эти "нечестивцы" - минералы кобальта и никеля, вводившие в заблуждение рудокопов Шнееберга? В сплошной массе или в тонкозернистом агрегате они и вправду очень похожи на руды серебра. Но приглядимся повнимательней.
"Никелева медь" - купферникель - самый неразличимый из лих: кристаллов он почти не образует, а только сплошные, тяжелые, тускло-блестящие медно-красные желваки и прожилки, удивительно напоминающие медь. Но самородная медь оставляет на матовом ободке на дне фарфорового блюдечка (бисквите) блестящую медно-красную черточку, а купферникель - никелин, красный никелевый колчедан (NiAs) - рисует на нем буровато-черную черту. Существует и другой, латунно-желтый игольчатый колчедан никеля NiS - миллерит. Его отличают именно по облику: тонким волосовидным и игольчатым кристалликам. Он редок и в Шнееберге. А вот один из распространенных там минералов - кобальтин, кобальтовый блеск (CoAsS); он, пожалуй, самый прилетный. Как и пирит, кобальтин часто образует красивые светлые, Злестящие кристаллы: кубики, октаэдры и даже запомнившиеся нам по пириту Пентагон додекаэдры. Его специфическое свойство, отличающее его от всех других минералов,- нежный розовато-серебристый оттенок. Никелевый двойник кобальтина - герсдорфит (NiAsS) - по форме кристаллов похож на кобальтин, но его стально-серый цвет никогда не бывает розоватым.
Есть минералы кобальта и никеля, вовсе не содержащие серы, чистые арсениды: саффлорит CoAs2 и раммельсбергит NiAs2. От других арсенидов никеля и кобальта их нетрудно отличить по форме кристаллов - тоненькие серебристые призмы, часто срастающиеся в звездочки и сферы. Но между собой они почти неразличимы! Минералоги безошибочно распознают их по хроматографической реакции: в азотной кислоте соли никеля приобретают нежно-яблочно-зеленый цвет, а соединения кобальта - ярко-розовый.
Так же точно приходится поступать, чтобы разобраться и в следующей паре минералов-близнецов, точнее, "тройняшек". Из них более богаты кобальтом скуттерудит (CoAs3) и смальтин (шмальтин, CoNiFeAs3±2), он-то, видимо, и входил в синюю кобальтовую краску Шюрера - смальту. Близкий минерал никеля - хлоантит NiAs3. Кристаллы и у этих минералов очень схожие: блестящие, хрупкие, серые или оловянно-белые кубики или октаэдры. Легко спутать эту троицу, и в зернистых массах помогает различить их химия. Но даже из названия никелевого близнеца ("хлоантес" по-гречески означает "зеленящий", "зеленеющий") видна способность минерала зеленить. Пользуется хроматографией и сама природа: природные яблочно-зеленые руды никеля - один из вторичных минералов, глиноподобный силикат гарниерит (Ni6Si4O10(OH)8) встречается обычно в коре выветривания ультраосновных пород (Урал, Новая Каледония) в форме землистых корок, но иногда там можно увидеть и лучистые сростки тонких кристалликов и натечные почковидные формы голубовато-зеленого или синевато-зеленого цвета.
Гарниерит образует совместно с другими очень близкими никельсодержащими силикатами (непуитом и ревденскитом) значительные скопления, пригодные для разработки. Назван этот минерал в честь французского геолога и минералога Ж. Гарнье, начальника горного департамента в Новой Каледонии. Ему посчастливилось открыть необычное месторождение нового и уже весьма ценившегося металла. Кроме Новой Каледонии, гарниерит - землистый, нежно-зеленый силикат никеля - часто встречается в некоторых месторождениях Урала, в Австралии, на острове Мадагаскар и на Кубе, там, где аридный климат способствовал энергичному выветриванию и окислению ультраосновных пород, содержащих никель: дунитов, перидотитов, серпентинитов.
Есть и еще один красивый минерал, окрашенный соединениями никеля, но не являющийся рудой. Это хризопраз - нежно-зеленая разновидность халцедона. Хризопраз прекрасно полируется и стойко держит свой приятный, свежий цвет.
...Так что химическую реакцию с получением разноцветных солей никеля и кобальта природа нередко производит сама, без нашего вмешательства, оставляя на нашу долю лишь восхищенное созерцание. Особенно четко это видно на еще одной паре минералов аналогичного состава: один из них никелевый, а другой кобальтовый. В зоне окисления первичных кобальто-никелевых руд вместо металловидных серебристо-белых, трудноразличимых арсенидов кобальта и никеля "расцветают" их арсенаты. Именно расцветают, их испокон веков так и называют: кобальтовые цветы и никелевые цветы. Цветы никеля впервые были описаны минералогами тоже в Саксонии в месторождении Аннаберг, оттого они и названы аннабергитом. Состав минерала - Ni3[AsO4]28H2O. Он отличается весенним яблочно-зеленым цветом. По присутствию аннабергита можно узнать и находящиеся рядышком первичные труднодиагностируемые минералы никеля. Аннабергит похож на зеленоватые охры, его кристаллики - тоненькие зеленые иголочки, даже скорее волосинки - встречаются редко, чаще это землистые массы. А вот у цветов кобальта - эритрина (от греческого "эритрос" - красный) - более распространены. Хороши они не только темно-малиновым или ярко-розовым цветом. Тонкие блестящие пластинки таких кристаллов нередко собраны в лучистые "соцветия". Но все же чаще и эритрин образует землистые розовые корки, очень похожие на засохшую краску.
Помимо "специальных" мышьяково-никель-кобальтовых руд, встречающихся, как мы уже знаем, в Рудных горах Центральной Европы, на Кавказе, в Канаде, важным источником никеля и никелевых сплавов служит пентландит - "коллективный" сульфид никеля и железа - железоникелевый колчедан [(Fe,Ni)9S8]. Он очень похож на халькопирит и пирротин. Отличается петландит лишь темным буроватым оттенком и неожиданным, сравнительно редким для сульфидов свойством: совершенной спайностью в четырех направлениях, по октаэдру. Своих кристаллов этот минерал почти никогда не образует. И даже отдельные скопления его редки. Чаще всего это неправильные зерна, вкрапленные в халькопирит или пирротин. Огромные запасы пентландит-халькопиритовых руд, содержащих никеля вдвое больше, чем меди, были еще в прошлом веке открыты при прокладке Тихоокеанской железной дороги в Канаде. Но долгое время никак не удавалось разделить никель и медь. Именно эта особенность пентландит-содержащих руд в конце концов послужила толчком для рождения нового оригинального сплава никеля и меди - монель-металла.
Президент Международной никелевой компании полковник Амброз Монель подал смелую идею: вовсе не разделять эти металлы, выплавлять естественный "натуральный сплав". Знаменитый монель-металл, получивший имя энергичного полковника, сейчас один из главных материалов химического машиностроения. Металлурги создали много марок монель-металла, но основа у них общая: 60-70% никеля и 28-30% меди, т. е. соотношение их остается таким же, каким оно было в руде.
Железа в земной коре, как мы помним, примерно 5%, никеля почти в тысячу раз меньше - 0,0058%, а кобальта еще меньше - всего 0,00018%. Впрочем, как считают ученые, и никель, и кобальт в земной коре лишь гости из глубины. Это доказывается и строением метеоритов, и анализом многих проб лунного грунта, и скважинами глубокого бурения, и в первую очередь составом наиболее глубинных пород, проникших сквозь сверхглубокие разломы на поверхность Земли.
Интересно, что глубоководные железомарганцевые конкреции океанского дна содержат примерно 20% марганца, 15% железа и по 0,5% никеля, кобальта и меди. Общие запасы кобальта в них почти вдвое больше, чем на суше.
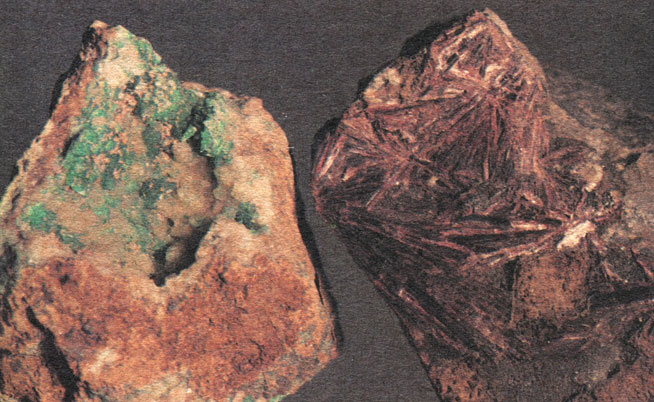
Аннабергит и эритрин
Геохимики предполагают, что гипотетическое ядро Земли состоит из железо-кобальто-никелевого сплава, содержащего 90,85% железа, 8,5% никеля и 0,6% кобальта. Тогда именно там сосредоточена почти вся масса этих металлов. Для никеля эта предполагаемая масса составляет около 17*1019 т (из всего имеющегося на планете 17,4*1019 т). Конечно, степень проникновения металла в нашу жизнь, доля его участия во всеобщем процессе, именуемом научно-техническим прогрессом, во многом определяется его долей в составе именно доступной нам части земного шара - земной коры - кладовой всех наших ресурсов. Но вот что интересно. Первые шаги кобальта и никеля во многом повторяют путь железа. Вы помните, при первом знакомстве человека с железом, состоявшемся в палеолите, т. е. 35-30 тысячелетий назад, минералы железа оказались великолепными красками: красными, рыжими, желтыми, бурыми. Они пережили десятки тысячелетий и донесли до нас ритмичный топот бизоньего стада, пересекающего, как степи, стены и своды Алтамирской пещеры в Испании, и мерную поступь мамонтов, пасшихся в Башкирии вокруг Капской пещеры. Минералы железа открыли нашему предку магию цвета и тайны собственного сознания, упоение властью над стихией пламенеющих красок. А кобальт? Его роль в земной коре и вправду роль пигмея, гнома: всего 18 г на 1 т породы. Но и его путь к человеку начался с краски - с небесно-синего жука скарабея, современника фараонов, с голубого фарфора поднебесной империи и синего венецианского стекла. Этот синий-синий след тянется сквозь века, начиная с лазурных скарабеев, уютной голландской печки, синей венецианской вазы или гжельской чашки и до синих огней аэродрома, встречающих прилет каждого самолета.
Цикламеново-розовые краски на основе солей никеля появились много позже. Зато в другой роли - роли ювелирного металла - именно никель прилежно пошел по стопам железа и во многом опередил его. Несмотря на уникальность метеоритного железа и его высочайшую ценность, железо как драгоценный металл давным-давно сошло на нет под натиском золота, серебра, платины. А никель, дебюту которого способствовали именно ювелиры, устоял в этой роли по сей день, правда с оговорками. Ибо вначале собственно никель, ясно блестящий, принимающий и хранящий полировку металл, казался привлекательным сам по себе. Наши прабабушки носили украшения из никеля. Хотя чистый никель ковкий и тягучий, малейшая примесь серы делает его хрупким, что и мешает механической обработке металла.
Декоративные свойства никеля снова вывели его на арену, но уже как необходимый ингредиент "серебровидных" сплавов.
Самый древний из них пактхонг (или пекфонг) выплавляли в Китае еще в III в. до н. э. Этот сплав состоял из меди, никеля и цинка. Никель, "отбеливая" красноту меди, придавал сплаву благородный облик серебра. В XIX в. в Европе фабриканты столового серебра объявили конкурс на создание "нового серебра" - более дешевого, но внешне не отличимого сплава. Премию получил Мельхиор Шарье, а сплав получил его имя "мельхиор" (в отличие от древнего китайского пактхонга и нового европейского аргентана мельхиор не содержит цинка, в нем присутствует до 1% марганец). Однако мельхиор не только красивый декоративный металл. Он отлично выдерживает удар струи и применяется в машиностроении для изготовления клапанов и кранов.
Широкое поле деятельности открылось перед никелем лишь после того, как были установлены его антикоррозийные свойства: никелированные металлы стойко переносили действие влаги и температуры. Для изготовления химической аппаратуры никель, не боявшийся таких "агрессоров", как концентрированные рассолы и расплавы солей, горячие щелочи, фтор, хлор и бром, оказался одним из самых перспективных металлов.
Великое множество никельсодержащих сплавов трудится на мирных фронтах НТР. Это конструкционные никелевые и хромо-никелевые сплавы. Среди них жаропрочный сплав с элегантным названием "инконель" - один из главных материалов ракетной техники. Этот "аристократ" содержит лишь малую долю железа, его основу составляют никель с добавкой хрома. Нихром (15% Cr, 60% Ni) - сплав с высоким сопротивлением - не знает конкурентов в электронагревательной технике, от кипятильника до промышленной муфельной печи.
Платинит платины не содержит, но может заменить ее в машинах химической и текстильной промышленности. Важно, что коэффициент температурного расширения платинита тот же, что у стекла и платины.
Есть сплавы, использующие такое уникальное свойство никеля, как его "музыкальность": стержень из никеля в переменном магнитном поле достаточной частоты становится источником ультразвука. Впрочем, это свойство, пожалуй, имеет больше отношения не столько к "музыкальности", сколько к магнитности. Среди магнитных никелевых сплавов на первом месте достоин упоминания пермаллой (FeNi3). Тонкие напыленные пленки пермаллоя - главный элемент машинной памяти, сердечники из пермаллоя можно обнаружить, разобрав любой телефонный аппарат. Магнитность - это уникальное свойство - ярко проявляется при обычной температуре лишь у трех элементов железной триады периодической системы Менделеева: железа и его ближайших родственников - никеля и кобальта. Поэтому все три металла широко используются при изготовлении магнитных материалов. Во второй мировой войне зловещую известность приобрели немецкие магнитные мины, "сами" устремлявшиеся под днище проплывающих кораблей. Их основой служила магнитная кобальтовая сталь.
Кобальт - самый сильный магнит из железной триады. Магниты из кобальтовых сплавов - магнико (магний, алюминий, кобальт) и альнико (алюминий, никель, кобальт) - гораздо сильнее привычных железных: магнит массой 100 г в состоянии удерживать груз 50 кг! Но бывают и более сильные - из самарий-кобальтовых сплавов.
"Сила" кобальтовых магнитов заключается и в том, что их труднее всего размагнитить: железо размагничивается при температуре + 769°С, никель - много раньше, уже при +358°С. Кобальт же только при нагревании до +1130°С теряет свою магнитность.
Кобальтовые стали - лучшие магнитные материалы, они не размагничиваются не только от нагревания, но и от вибрации.
Есть и еще одно семейство кобальтсодержащих суперсплавов. Они появились в начале века и были названы стеллиты (от "стелла" - звезда). В этих "звездных" сплавах кобальт, хром и вольфрам тоже вытеснили железо. Один из лучших стеллитов наполовину состоял из кобальта. Стеллиты явились основой сегоднящних сверхтвердых быстрорежущих сталей.
Многим известна фраза автомобильного "короля" Г. Форда: "Если бы не было ванадия, то не было бы и автомобиля". В свое время это было справедливо. Но не хуже звучит и фраза Б. И. Казакова, автора книги "Баллада о металле" (Алма-Ата, 1966): "Если бы не было кобальта, то не было бы и эмалированной кастрюли". И это сказано не ради красного словца! Долгое время эмаль никак не хотела "прирастать" к кастрюлям и мискам, отскакивала, пока не изобрели хитрую уловку - двухслойную эмаль. Первый слой, прилегающий к железной основе, содержит всего лишь 0,6% кобальта, но и этого оказывается достаточно, чтобы ионы кобальта, диффундирующие при нагреве внутрь чугунного или железного слоя, намертво "приварили" эмаль к посуде.
Есть у кобальта и еще одно свойство, открывающее ему уникальное поле деятельности. Помимо обычного кобальта, в природе существуют 12 радиоактивных его изотопов. Наиболее известный кобальт-60 по мощности радиоактивного излучения почти в 60 раз превосходит радий. Крупицы изотопа кобальт-60 помещают в специальные пушки. Зарядом кобальтовой пушки медики бомбардируют ткани злокачественной раковой опухоли: кобальт-60 не дает больным клеткам разрастаться, ликвидируя очаги одной из самых страшных болезней человечества. Но кобальтовая пушка не единственная его служба в медицине. Как утверждают врачи, около 4% кобальта содержится в веществе сырой печени (или в витамине B12), спасающем людей при злокачественном малокровии.
Добавка 1 мг соединений кобальта в 1 кг пищи сельскохозяйственных животных (например, коров и овец) сильно повышает содержание гемоглобина в крови, а резкий дефицит кобальта в кормах вызывает анемию. Ученые считают, что биологические функции кобальта связаны с кроветворным процессом.
Стенды для обоев купить от производителя: цены на стенды для обоев вот здесь.
|
ПОИСК:
|
При использовании материалов сайта активная ссылка обязательна:
http://metallurgu.ru/ 'Библиотека по металлургии'