
§ 25. Диаграмма состояния системы железо - углерод
Подавляющая масса железа применяется в виде сплавов с углеродом - сталей и чугунов. Поэтому необходимо подробно рассмотреть систему железо - углерод. На рис. 46 представлена часть этой диаграммы, прилегающая к железу и ограниченная содержанием 6,67% С. При больших содержаниях углерода сплавы практического значения не имеют, и обычной плавкой их получить невозможно. Между железом и углеродом образуется промежуточная фаза в виде соединения - карбида железа Fe3C, содержащего теоретически 6,67%С и плавящегося около 1600°С . Поэтому представленную часть диаграммы состояния системы железо - углерод можно рассматривать как полную диаграмму состояния системы железо - карбид железа.
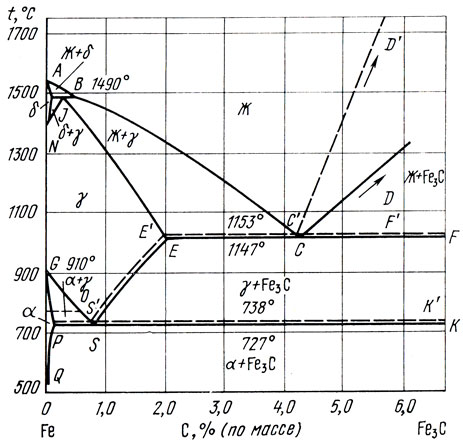
Рис. 46. Диаграмма состояния системы железо - углерод
На диаграмме, изображенной на рис. 46, кроме сплошных линий, нанесены пунктирные, которые относятся к системе железо - графит. Соединение Fе3С - неустойчиво, и при длительных отжигах или очень медленном охлаждении распадается на железо и графит. Поэтому система железо - карбид железа должна рассматриваться как неустойчивая, метастабильная, а система железо - графит - как устойчивая. Диаграмму той или другой системы следует использовать, исходя из реальной обстановки, в которой были получены сплавы.
Все точки на диаграмме состояния железо - углерод имеют общепринятые интернациональные обозначения, поэтому их необходимо запомнить. На ординате чистого железа имеются точки A, N, G, которые отражают соответственно плавление - кристаллизацию и превращения А4 и А3. Магнитное превращение А2 изображено точкой М. На диаграмме состояния видно, что выше точки плавления железа и карбида железа в этой системе образуется однородный жидкий раствор, обозначенный буквой Ж. Это значит, что углерод хорошо растворяется в жидком железе до 6,67%. Из-за полиморфизма железа в системе образуются три твердых раствора углерода в δ-, γ- и α-модификациях железа. Эти растворы обозначаются теми же греческими буквами. Следует обратить внимание на то, что растворы на основе α- и δ- железа с объемноцентрированной кубической решеткой резко отличаются по предельному содержанию углерода в сравнении с раствором на основе γ-железа с гранецентрированной кубической решеткой. В δ-железе наибольшая растворимость углерода составляет 0,1% при 1490°С (точка Н), в α-железе при 727°С растворяется всего 0,02% (точка Р), а при 400°С - менее 0,002%. В γ-железе растворимость углерода достигает 2,14% при 1147°С (точка Е).
Столь резкая разница в способности растворять углерод объясняется тем, что в гранецентрированной кубической решетке, несмотря на более плотную упаковку атомов, имеются большие по размерам промежутки в центре кубической ячейки. Именно в этих местах и размещаются атомы углерода. При этом они несколько деформируют кристаллическую решетку и вызывают увеличение линейных размеров элементарной ячейки. При определенной концентрации углерода его атомы вызывают настолько большие искажения в решетке, что она делается неустойчивой, и появляется другая фаза - карбид. В железе с объемноцентрированной кубической решеткой атомы углерода размещаются в центрах граней элементарной ячейки, и так как в этих местах промежутки между атомами железа значительно меньше, то предельные искажения решетки наступают при существенно меньших содержаниях углерода.
Кристаллизация сплавов железа, содержащих до 0,5%С (точка В), начинается с выпадения кристаллов δ-железа. Сплавы с 0 - 0,1% С целиком кристаллизуются в δ-твердый раствор. Затем при понижении температуры фигуративные точки, изображающие эти сплавы, пересекают линию NH и попадают в двухфазную область δ+γ, где идет постепенное превращение фазы δ в фазу γ. Поскольку система двухкомпонентна (железо + углерод) и двухфазна (δ+γ), число степеней свободы С = К-Ф+1 = 2-2+1 = 1, то превращение происходит в интервале температур, определяемом линиями NH и NJ. Ниже температур, ограниченных линией HJ, все сплавы с 0 - 0,1% С представляют однородный твердый раствор на основе γ-железа. В сплавах, содержащих от 0,1 до 0,16% С, происходит перитектическая реакция Ж+δ→γ при 1490°С на горизонтали HJB. В результате вся жидкость исчезает, а сплавы приобретают двухфазную структуру δ+γ. В интервале температур от горизонтали HJB до линии NJ δ-фаза постепенно исчезает, превращаясь в γ-фазу. В сплаве, содержащем точно 0,16%С, перитектическая реакция Ж+δ→γ завершается таким образом, что полностью расходуются и δ-кристаллы, и жидкость, так что сплав после 1490°С оказывается γ-твердым раствором. В сплавах с содержанием углерода от 0,16 до 0,5% (от точки J до точки В) в ходе перитектической реакции при 1490°С расходуются все прежде выпавшие δ-кристаллы, но остается часть жидкости, из которой при дальнейшем понижении температуры выпадают кристаллы γ-твердого раствора вплоть до полной кристаллизации.
Сплавы с 0,5 - 2,14%С (от В до Е) кристаллизуются как твердые γ-растворы, при этом состав жидкости описывается линией ликвидуса ВС, а состав кристаллов линией солидуса JE. В более богатых углеродом сплавах, содержащих от 2,14 до 4,3% этого элемента (от точки Е до С), в ходе выпадения кристаллов у- раствора жидкость достигает точки С, после чего происходит эвтектическая реакция Ж→γ+Fе3С. Поскольку налицо три фазы, то в двухкомпонентной системе число степеней свободы С = К-Ф+1 = 2-3+1 = 0. Поэтому во всех этих сплавах кристаллизация будет заканчиваться при постоянной и одинаковой температуре, равной 1147°С. Чем больше углерода в этом интервале концентраций, тем ниже температура начала кристаллизации, тем меньше количество первичных кристаллов γ-раствора и тем больше количество эвтектической составляющей в структуре.
Самый низкоплавкий сплав с 4,3% С, представляющий чистую эвтектику, кристаллизуется и плавится при постоянной температуре 1147°С. При больших содержаниях углерода (от 4,3 до 6,67%) кристаллизация начинается с выпадения первичных кристаллов карбида железа и заканчивается также при 1147°С образованием эвтектики γ+Fе3С. Чистый карбид железа плавится около 1600°С, растворимостью железа в нем практически можно пренебречь.
Таким образом, ниже 1147°С все сплавы в рассматриваемой системе оказываются в твердом состоянии. Однако при дальнейшем понижении температуры во многих из них происходят глубокие изменения фазового состава. При 1147°С все сплавы, содержащие от 0 до 2,14% С, представляют однородные твердые γ-растворы. Более богатые углеродом сплавы имеют двухфазную структуру, состоящую из γ-раствора и фазы Fе3С. Количество каждой из фаз зависит от содержания углерода, т. е. от положения сплава на диаграмме состояния, и определяется правилом рычага. Так, в сплаве с 4,3% С (чистая эвтектика γ+Fе3С) γ-фаза составляет, % (по массе):
(6,67-4,3) : (6,67-2,14) = 52, а фаза Fe3C-(4,3-2,14) : (6,67-2,14) = 48, или просто по разности 100% - 52% = 48%. При 3,3% С доля γ-фазы равна (6,67-3,3) : (6,67-2,14) = 74%, а фазы Fe3C - 36%.
При понижении температуры сплавы, содержащие до 0,02% С (точка Р), целиком превращаются в α-растворы. Это превращение совершается, как и следует, по правилу фаз в интервале температур, определяемым расстоянием по вертикали между линиями GS и GP. При этом состав появляющейся α-фазы описывается линией GP, а исчезающей γ-фазы - линией GS. В сплавах, содержащих более 0,02% С, γ-фаза в ходе превращения достигает при температуре 727°С точки 5 (0,8% С). Эта точка называется эвтектоидной, так как здесь γ-фаза превращается одновременно в две фазы - α и Fe3C.
Таким образом все сплавы, содержащие от 0,02 до 2,14% С, попадая на эвтектоидную горизонталь PSK, при 727°С испытывают эвтектоидное превращение. Однако в сплавах, содержащих от 0,02 до 0,8% С, эвтектоидному превращению предшествует выделение α-фазы по линии GP из γ-фазы, состав которой описывается линией GS. В сплавах, содержащих от 0,8 до 2,14% С, из γ-фазы предварительно выделяется фаза Fe3C, при этом состав γ-фазы изменяется по линии ES.
Во всех сплавах с содержанием углерода от 2,14 до 6,67% непосредственно после эвтектического превращения при 1147°С концентрация углерода в γ-фазе составляет 2,14% (точка Е). Снижение температуры, как видно, сопровождается обеднением γ-раствора по углероду до 0,8% (точка S). Это означает, что из γ-фазы должно выделяться определенное количество фазы Fе3С. Это количество нетрудно найти по правилу рычага. Например, в сплаве эвтектического состава с 4,3% С при 1147°С, как было показано ранее, содержится 48% (по массе) карбида железа Fe3C. При 727°С перед эвтектоидным превращением количество фазы Fе3С должно быть (4,3-0,8) : (6,67-0,8) = 59%, т. е. появилось дополнительно 11% карбида железа. Оставшаяся γ-фаза (41%), достигшая точки S, распадается по эвтектоидной реакции на α-фазу и карбидную фазу Fe3C. После эвтектоидной реакции в сплаве с 4,3% С оказывается (4,3-0,02) : (6,67-0,02) = 64% карбида Fe3C и 36% α-фазы; при достижении 500°С из-за уменьшения растворимости углерода в α-фазе до менее 0,002% количество карбида увеличивается до (4,3-0,002) : (6,67-0,002) = 64,3%, а количество α-фазы уменьшается до 35,7% (по массе).
Таким образом, все сплавы железа с углеродом ниже 500°С в равновесном состоянии имеют две фазы: α и Fe3C. Фаза α представляет твердый раствор углерода в α-железе с очень небольшой концентрацией углерода (менее 0,002%). Фаза Fe3C - карбид почти стехиометрического состава, т. е. содержание железа и углерода в ней строго соответствует химической формуле.
На диаграмме нанесена штрих-пунктирная линия МО, изображающая магнитное превращение в α-фазе. Поскольку температура превращения (точка Кюри) практически не изменяется от присутствия небольших количеств углерода (около 0,01%), эта линия горизонтальна и проходит только в двух фазовых областях, где существует α-фаза.
Обозначения фазовых превращений, принятые для чистого железа, сохраняются для сплавов железа с углеродом. В сплавах температуры превращения A4 и A3 переменны в зависимости от содержания углерода и описываются на диаграмме состояния линиями NJ и GS соответственно. Кроме того, в сплавах с углеродом появляется новое превращение A1 - это эвтектоидное превращение при постоянной температуре 727°С. Как видно, в сплаве с 0,8% С превращение A3 сливается с превращением A1.
Фазовое превращение, совершающееся по линии ES (выделение из γ-фазы карбида железа), принято обозначать Aст. В сплавах железо-углерод проходит еще одно превращение, отсутствующее в чистом железе и связанное с переходом карбида железа при охлаждении в ферромагнитное состояние. Это превращение совершается при температуре около 210°С и обозначается A0.
Ниже приведены координаты точек диаграммы состояния системы железо - углерод (по температуре и концентрации), а в табл. 4 перечислены наиболее важные превращения с их условными обозначениями.
| Точка на диаграмме состояния железо - углерод | A | B | C | D | E | F | G | H | J | K | M | N | P | S |
| Температура, °С | 1536 | 1490 | 1147 | 1600 | 1147 | 1147 | 910 | 1490 | 1490 | 727 | 770 | 1390 | 727 | 727 |
| Содержание углерода, % (по массе) | 0 | 0,5 | 4,3 | 6,67 | 2,14 | 6,67 | 0 | 0,1 | 0,16 | 6,67 | 0 | 0 | 0,02 | 0,8 |
Диаграмму состояния системы железо - углерод изучают уже более 100 лет, но до сих пор продолжается ее уточнение. Начало изучения этой системы было положено великим русским металлургом Д. К. Черновым. В 1868 г., работая на Обуховском сталелитейном заводе в Петербурге, он на основе визуальных наблюдений и глубокой научной интуиции обнаружил превращение в твердой стали при температуре красного каления. Д. К. Чернов назвал эти критические температуры точками а и b. Точка а была ничем иным, как эвтектоидным превращением А1 при 727°С. Точка b, по-видимому, соответствовала превращению A3.
Таблица 4. Наиболее важные превращения в системе железо-углерод
| Условное обозначение превращения | Температура и природа превращения |
| А0 | Около 210°С; наблюдается только в сплавах с углеродом, связано с переходом карбида железа в ферромагнитное состояние при охлаждении |
| А1 | 727°С; наблюдается только в сплавах с углеродом, связано с эвтектоидной реакцией γ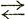 α+Fe3C по линии PSK α+Fe3C по линии PSK |
| А2 | Около 770°С; связано с переходом α-железа в ферромагнитное состояние при охлаждении (точка Кюри) |
| А3 | Совершается по линии GS при разных температурах от 910 до 727°С в зависимости от содержания углерода, связано с переходом γ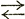 α α |
| Аст | Совершается по линии SE при разных температурах от 1147 до 727°С в зависимости от содержания углерода, связано с переходом γ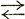 Fе3С Fе3С |
| А4 | Совершается по линии NJ при температурах от 1390 до 1490°С в зависимости от содержания углерода, связано с переходом γ δ δ |
Фазовые составляющие в системе железо - углерод, а также эвтектическая и эвтектоидная смеси фаз носят общепринятые интернациональные названия. Твердый раствор углерода в α-железе (и δ-железе) называют ферритом (от латинского "ferrum" - железо), твердый раствор углерода в γ-железа - аустенитом в честь английского ученого-металловеда Робертс-Аустена, карбид железа Fe3C - цементитом из-за его большой твердости. Эвтектическую смесь γ-раствора (аустенита) и карбида Fe3C (цементита) называют ледебуритом в честь немецкого металловеда Ледебура, эвтектоидная смесь α-раствора (феррита) и карбида Fe3C (цементита) - перлитом за перламутровый цвет шлифа после травления.
Феррит мягок и пластичен, имеет твердость НВ (60 - 130) в зависимости от величины зерна и степени холодной деформации. Относительное удлинение феррита в отожженном состоянии около 40%. Ниже 770°С он ферромагнитен, выше этой температуры (точки Кюри) парамагнитен. Цементит очень тверд (HRC 80) и хрупок. Имеет точку Кюри при 210°С. Различают первичный, вторичный и третичный цементит. Первичный цементит выделяется из жидкости по линии DC, вторичный - из аустенита по линии ES, третичный - из феррита по линии PQ. Аустенит, как видно из диаграммы состояния системы железо - углерод, существует лишь при высоких температурах. Его так же, как и γ-фазу в чистом железе, почти невозможно сохранить при низких температурах. Однако с помощью специальных мер удалось переохладить аустенит в двойных сплавах железа с углеродом и исследовать его свойства. Он оказался более твердым, нежели феррит (НВ 200 - 250), но столь же пластичен.
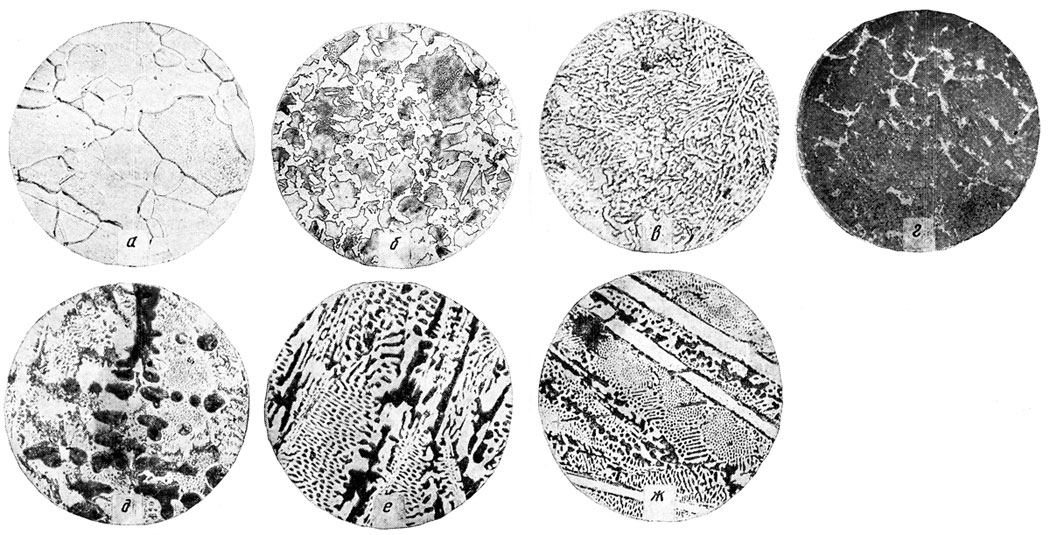
Рис. 47. Микроструктура сплавов железа с углероом. х100: а - 0,01% С; б - 0,6% С; в - 0,8% С (х600); г - 1,2% С; д - 3% С; е - 4,3% С; ж - 5% С
Несмотря на то что при комнатной температуре практически все сплавы железа с углеродом имеют двухфазную структуру, состоящую из феррита и цементита, вид структуры резко различен из-за прошедших в процессе охлаждения превращений. Сплавы с очень малым содержанием углерода (менее 0,01%) состоят практически из одного феррита (рис. 47, а). Лишь очень редко по границам зерен попадаются тонкие прослойки третичного цементита. Структура сплава железа с 0,6% С состоит из феррита и перлита (рис. 47, б). Светлые зерна - феррит, темные сильно протравившиеся участки - перлит. При большом увеличении можно видеть двухфазное строение перлита. При обычных условиях охлаждения (около 100 град/мин) перлит имеет пластинчатое строение, при этом чередующиеся пластинки цементита и феррита имеют толщину около 1 - 2 мкм. В структуре сплава с 0,8% С обнаруживается сплошной перлит (рис. 47, в). В сплаве с 1,2% С в структуре можно видеть вторичный цементит в виде светлых прожилок, появившихся из аустенита, и темные поля перлита (рис. 47, г). Доэвтектический сплав железа с 3% С имеет структуру (рис. 47, д), в которой можно различить дендриты аустенита, претерпевшего затем эвтектоидный распад и превратившегося в перлит. Остальное поле занимает эвтектика (ледебурит), которая сразу после кристаллизации состояла из аустенита и цементита. При 727°С включения аустенита также превратились в перлит. Эвтектический сплав железа с 4,3% С обладает чисто эвтектической структурой, состоящей из смеси выделений цементита и перлита, образовавшегося на месте аустенита (рис. 47, е). В структуре заэвтектического сплава с 5% С (рис. 47, ж) хорошо различимы светлые иглы первичного цементита и эвтектика из перлита (бывшего аустенита) и цементита.
Все описанные структуры, присущие сплавам системы железо - карбид железа, получены при средних скоростях охлаждения 50 - 100 град/мин, Если сплавы охлаждаются очень медленно или подвергаются длительным отжигам, то для понимания возникающих структур необходимо обратиться к системе железо - графит. Фазовые переходы в этой системе изображены на рис. 46 пунктирными линиями, проходящими на 7 - 10°С выше сплошных. В равновесном состоянии все сплавы системы железо - графит при комнатной температуре имеют двухфазную структуру, состоящую из феррита и включений графита. Включения графита тем крупнее, чем больше было содержание углерода и чем длительнее были отжиги.
Все сказанное выше относится к двойной системе железо - углерод. В используемых в технике железоуглеродистых сплавах всегда содержатся марганец и кремний (от десятой доли % и более) и примеси серы и фосфора (сотые доли процента). Следовательно, эти сплавы не двухкомпонентные, а более сложные. Поэтому использовать диаграмму состояния двойной системы железо - углерод для выяснения фазовых превращений в таких сложных сплавах необходимо с большой осмотрительностью. Прежде всего присутствие других компонентов изменит температуры превращений. Обычно эти температуры понижаются. Далее, перитектическое, эвтектическое и эвтектоидное превращения, происходящие в двухкомпонентной системе при постоянной температуре перестанут быть нонвариантными и будут проходить в интервале температур.
Применяемые в технике железоуглеродистые сплавы делят на две группы в зависимости от содержания углерода. Сплавы, содержащие до 2,14% С (точка Е на диаграмме состояния системы железо - углерод), называются углеродистыми сталями. Их отличительная особенность состоит в том, что они кристаллизуются как твердые растворы, в их структуре отсутствует эвтектика (ледебурит или железо - графит). Сплавы, содержащие более 2,15% С, называют чугунами.
|
ПОИСК:
|
© METALLURGU.RU, 2010-2020
При использовании материалов сайта активная ссылка обязательна:
http://metallurgu.ru/ 'Библиотека по металлургии'
При использовании материалов сайта активная ссылка обязательна:
http://metallurgu.ru/ 'Библиотека по металлургии'