
§ 11. Диаграммы состояния двойных систем с промежуточными фазами
В некоторых случаях в сплавах могут появиться кристаллы, не похожие по виду и свойствам на кристаллы исходных компонентов и обладающие своей кристаллической решеткой. Такие образования называются промежуточными фазами. Промежуточные фазы могут иметь как строго постоянный, так и переменный состав. Связи между атомами в промежуточных фазах могут быть металлического типа, ковалентными, гетерополярными.
Между элементами, далеко отстоящими один от другого в таблице Менделеева, могут образовываться химические соединения. В этих соединениях между атомами имеется ярко выраженная ионная (гетерополярная) связь, а их состав отвечает формулам, в которых компоненты имеют обычные химические валентности. Подобными соединениями являются Mg2Si, PtSn2, Mg3Sb2 и др.
В большинстве случаев связь между атомами в промежуточных фазах бывает либо металлической, либо ковалентной, либо может осуществляться смешанный тип связи. Большая группа промежуточных фаз называется электронными соединениями. Они характеризуются тем, что имеют примерно постоянное отношение числа валентных электронов от атомов обоих компонентов к общему числу атомов. Это отношение может составлять 3:2, 21:13, 7:4. Примерами электронных соединений могут служить CuZn, NiAl, Cu5Zn8, Ag3Sn, Cu3Sn. Отличительной особенностью электронных соединений является их способность давать обширные области твердых растворов замещения с обоими компонентами. При этом, конечно, отношение числа валентных электронов к числу атомов несколько меняется, но кристаллическая решетка соединения сохраняется.
Среди промежуточных фаз большую долю составляют фазы Лавеса, имеющие формулу АВ2, но также часто способные давать растворы замещения с обоими компонентами и поэтому существующие в интервале концентраций. Фазами Лавеса являются соединения FeBe2, MoFe2, TiCr2, ZnW2.
Большую группу промежуточных фаз составляют фазы внедрения, образующиеся между переходными металлами (см. § 1) и металлоидами, имеющими малый размер атома - углеродом, азотом, водородом, бором. Свое название эти фазы получили потому, что атомы металлоидов размещаются в промежутках между атомами металла, находящимися в узлах собственной решетки. Таким образом, атомы металлоида как бы внедрены в решетку, образуемую атомами металла и расположены там в определенном порядке. При этом последняя не является решеткой чистого металла. В целом кристаллическая решетка фазы внедрения отлична как от решетки металла, так и от решетки металлоида. Состав фаз внедрения в среднем может соответствовать формулам Ме3Х, Ме2Х, МеХ и более сложным, где Me - металл, X - металлоид. Однако обычно фазы внедрения существуют в довольно широком интервале концентраций. Фазы внедрения, как правило, тверды, хрупки и тугоплавки. Примером фаз внедрения могут служить Fe3C, Fe4N, WC, TiC, ZrB2.
Как уже указывалось в § 1, ряд промежуточных фаз, образованных металлами второй и третьей групп периодической системы элементов Д. И. Менделеева с элементами шестой и пятой групп, обладает полупроводниковыми свойствами. Все эти соединения имеют общую формулу АВ и существуют в очень узком интервале концентраций, описываемом этой формулой. Такие соединения обладают либо кубической решеткой типа алмаза, либо гексагональной решеткой. При этом атомы металла расположены таким образом, что их ближайшими соседями являются атомы металлоида. Примером соединений с алмазной решеткой могут служить арсениды и фосфиды галлия и индия GaAs, GaP, InAs, InP. Сульфиды и селениды кадмия и ртути - CdSe, CdS, HgSe - обладают гексагональной решеткой.
Кроме описанных, имеются и другие типы промежуточных фаз. Следует отметить, что промежуточные фазы, образующиеся между металлами, часто называют металлическими или интерметаллическими соединениями в отличие от промежуточных фаз, образованных металлом и металлоидом.
Диаграммы с устойчивой промежуточной фазой
Подобные диаграммы изображены на рис. 19, а и б. Устойчивость промежуточной фазы АmВn выражается в том, что она сохраняется вплоть до точки плавления и плавится как самостоятельное вещество при постоянной температуре. Нетрудно убедиться, что по вертикали, соответствующей соединению АmВn, диаграмму можно разделить на две самостоятельные диаграммы эвтектического типа и изучать каждую из них отдельно. Диаграмма на рис. 19, а не содержит твердых растворов ни на основе компонентов, ни на основе соединений.
Если компоненты в твердом состоянии образуют ограниченные твердые растворы, а промежуточная фаза имеет переменный состав, то диаграмма состояния принимает вид, изображенный на рис. 19, б. Здесь α- и β-твердые растворы на основе компонентов А и В, а у - промежуточная фаза переменного состава, т. е. твердый раствор на ее основе. Если γ-фаза представляет фазу внедрения, то α-твердый раствор является твердым раствором внедрения компонента В в А. В таких растворах небольшие по размерам атомы металлоида (углерода, азота, кислорода, водорода) размещаются не в узлах решетки металла, как это имеет место в твердых растворах замещения, а в промежутках между атомами, как бы внедряясь в решетку металла, слегка увеличивая ее параметры. Эту диаграмму также можно разделить на две диаграммы эвтектического типа с ограниченной растворимостью в твердых фазах.
Диаграмма с неустойчивой промежуточной фазой
Как видно на рис. 19, в, промежуточная фаза γ в этой системе существует только до температуры перитектической горизонтали tр. Фаза γ образуется при кристаллизации в ходе перитектического превращения из жидкости состава с' и кристаллов β-раствора d'. Сплавы, составы которых находятся между точками с и g, кроме перитектического, испытывают еще один вид нонвариантного превращения - эвтектический. Неизрасходованная при перитектическом превращении часть жидкой фазы при понижении температуры кристаллизуется с образованием промежуточной фазы γ, пока не достигнет точки Е, после чего происходит эвтектическое превращение Ж→α+γ.
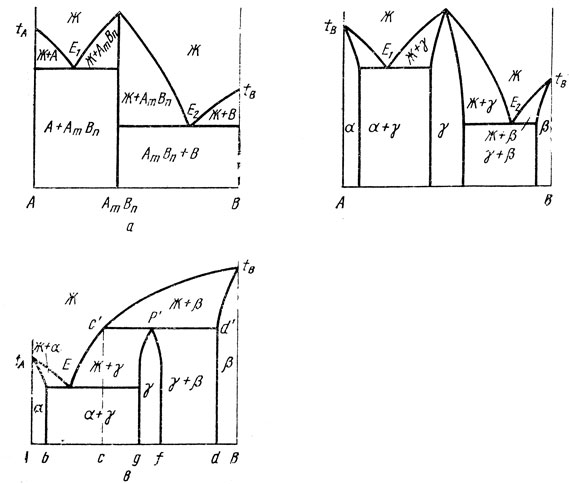
Рис. 19. Диаграммы состояния двойной системы с устойчивой (а, б) и неустойчивой (в) промежуточными фазами
|
ПОИСК:
|
© METALLURGU.RU, 2010-2020
При использовании материалов сайта активная ссылка обязательна:
http://metallurgu.ru/ 'Библиотека по металлургии'
При использовании материалов сайта активная ссылка обязательна:
http://metallurgu.ru/ 'Библиотека по металлургии'