
§ 9. Диаграмма состояния двойной системы с неограниченной растворимостью компонентов в жидкой и твердой фазах
Эта диаграмма состояния имеет очень простой вид (рис. 13). В ней имеются всего три фазовые области. При высоких температурах существует однородный жидкий раствор, обозначенный Ж, при низких температурах - однородный твердый раствор α. Имеется также промежуточная двухфазная область, обозначенная Ж+α, разделяющая однофазные области.
Твердым раствором называют фазу с решеткой компонента А, в которой часть узлов занята атомами другого компонента В. В данном случае компоненты А и В обладают одним типом кристаллической решетки, в узлах которых могут размещаться атомы обоих компонентов в любых соотношениях - от 0 до 100%. Подобные твердые растворы, где атомы компонентов замещают друг друга, называют растворами замещения.
Рассмотрим превращения, которые будут происходить со сплавом состава 1 при охлаждении с температуры t0. Для этого проведем ординату из точки 1 на оси составов до t0 и проследим, через какие фазовые области будет проходить точка, изображающая охлаждающийся сплав 1, при движении сверху вниз от t0 до нулевого значения температуры. Такую мысленно подвижную точку называют фигуративной. При температурах от t0 до t3 точка оказывается в однофазной области жидкого раствора Ж, следовательно сплав 1 будет в жидком однофазном состоянии. При температуре t3 фигуративная точка попадает в двухфазную область, где сосуществуют Ж - жидкий раствор и α-твердый раствор. Следовательно, при t3 сплав 1 начнет кристаллизоваться, в нем появится твердая фаза. Поскольку теперь в сплаве имеются две фазы, а сплав двухкомпонентный, то по правилу фаз число степеней свободы будет равно С = 2-2+1 = 1. Это означает, что в отличие от чистых компонентов сплав 1 сохраняет двухфазное состояние при изменении температуры, т. е. он кристаллизуется в интервале температур. На диаграмме этот интервал определяется шириной двухфазной области Ж+α при данном составе.
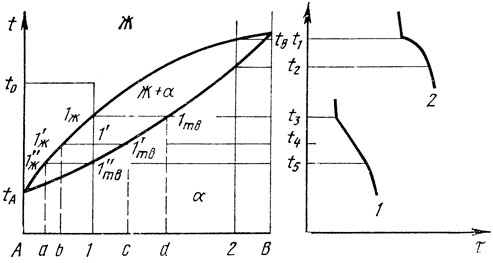
Рис. 13. Диаграмма состояния двойной системы с неограниченной растворимостью компонентов в твердой и жидкой фазах
Кристаллизация сплава 1 закончится при температуре t5, когда фигуративная точка выйдет из двухфазной области и окажется в однофазной области твердого раствора ос. После этого никаких фазовых изменений в сплаве 1 не будет вплоть до полного охлаждения. На кривой охлаждения сплава 1 при t3 возникает перегиб из-за того, что начинается кристаллизация, и падение температуры с этого момента замедляется, поскольку от образца теперь отводится не только теплота, определяемая теплоемкостью, но и теплота кристаллизации. При t5 кристаллизация заканчивается, и падение температуры вновь ускоряется, поэтому при t5 на кривой охлаждения возникает еще один перегиб.
Сплав 2 будет испытывать точно такие же превращения, как и сплав У, но он начнет кристаллизоваться при t1, а закончит - при t2.
Очевидно, что описанная схема кристаллизации присуща всем сплавам данной системы. Линия, разделяющая фазовые области Ж и Ж+α, является линией начала кристаллизации сплавов и называется линией ликвидуса. Линия, разделяющая фазовые области Ж+α и α, является линией конца кристаллизации сплавов и называется линией солидуса.
Рассмотрим более подробно ход кристаллизации сплава Кристаллизация, как указывалось, начинается при t3. При этой температуре из жидкости, находящейся в точке 1Ж на кривой ликвидуса, появляется бесконечно, малое количество твердой фазы, состояние которой изображается точкой 1ТВ. Как видно на рис. 13, точка 1ТВ находится на кривой солидуса на пересечении с горизонтальной прямой, соответствующей температуре t3, т. е. первые кристаллы резко отличаются от среднего состава сплава 1. Они обогащены тугоплавким компонентом. Дальнейшее понижение температуры не вызывает изменения числа фаз, пока сплав находится в двухфазной области Ж+α, однако состав фаз и их соотношение непрерывно меняются. Состояние жидкости описывается участком линии ликвидуса от точки 1Ж до точки 1"Ж, а состояние кристаллов - участком линии солидуса от 1ТВ до 1"ТВ. Твердая фаза по ходу кристаллизации непрерывно обогащается легкоплавким компонентом, состав кристаллов меняется от d к точке 1, т. е. непрерывно приближается к среднему составу сплава 1. Жидкость, напротив, непрерывно удаляется по составу от исходного сплава, обогащаясь легкоплавким компонентом до точки а. Это происходит при температуре t5, когда в сплаве 1 заканчивается кристаллизация, и он оказывается однофазным твердым α-раствором.
Таким образом, по диаграмме состояния можно определить состав твердой и жидкой фаз при любой температуре в ходе кристаллизации.
Диаграмма состояния позволяет также определять количества каждой из фаз по так называемому правилу отрезков или правилу рычага. Как видно на рис. 13, при t4 в сплаве 1 имеется жидкость, состояние которой описывается точкой 1'Ж, и кристаллы, описываемые точкой 1'ТВ. Жидкость имеет состав, соответствующий точке b, кристаллы имеют состав точки с. Если принять общую массу всего сплава за 1, а массовую долю кристаллов за х, то доля жидкости будет 1-х. Напишем уравнение материального баланса компонента В в обеих фазах. Всего количество (масса) компонента В в сплаве 1 равно отношению отрезков 1А/АВ. В кристаллах компонента В будет содержаться х(сА/АВ), в жидкости - (1-х)х(сА/АВ). Следовательно, 1А/АВ = х(сА/АВ) + (1-х) (bА/АВ). Отсюда получаем: х = 1b/bc, а 1-х = 1с/bс. Таким образом, чтобы найти количество сосуществующих фаз на диаграмме состояния двойной системы при заданной температуре, надо провести линию в двухфазной области, соединяющую точки, соответствующие данным фазам, и тогда отношение отрезка между точкой среднего состава сплава и одной фазы ко всей длине линии будет изображать количество другой фазы.
Рассматривая состояние любого сплава в данной системе при температуре, когда он находится в двухфазной области, необходимо иметь в виду, что двухфазное состояние сплава будет стабильным и количество каждой фазы и их состав будут неизменными сколь угодно длительное время, если температура поддерживается постоянной.
Изменения фазового состава сплавов могут происходить строго по описанной схеме только при условии, что во всем объеме сплава температура в любой момент времени совершенно одинакова, а каждая из фаз имеет совершенно однородный состав. Такое условие может быть выполнено лишь при бесконечно малой скорости охлаждения. В реальной обстановке охлаждение происходит с достаточно большой скоростью, поэтому в сплавах рассматриваемого типа в ходе кристаллизации не в полной мере успевают проходить диффузионные процессы, которые должны обеспечивать постоянство состава во всем объеме жидкости и кристаллов. Следствием этого отставания является дендритная ликвация - микронеоднородность состава в пределах одного кристалла. При неравновесных условиях кристаллы в металлах растут не в виде многогранников, а в виде дендритов - древовидных образований. Стволы и оси дендритов вырастают первыми и оказываются сложенными из более тугоплавкого материала (примерно состава cd' для сплава 1 по рис. 13, а промежутки между осями дендритов заполняются более легкоплавкой жидкостью, которая затем кристаллизуется (составы аb на рис. 13). По окончании кристаллизации это различие в составе осей дендритов и промежутков между осями не исчезает и может быть выявлено (рис. 14).

Рис. 14. Микроструктура литого сплава медь - олово с выявленными дендритами. x100
Диаграмма состояния, изображенная на рис. 13, характерна тем, что температуры начала кристаллизации всех сплавов лежат между температурами кристаллизации чистых компонентов, и увеличение содержания тугоплавкого компонента вызывает повышение температуры начала кристаллизации сплавов, а повышение содержания легкоплавкого компонента оказывает противоположное влияние. Встречаются разновидности этого типа диаграмм состояния. В некоторых случаях температуры начала и конца плавления сплавов понижаются при добавлении второго компонента как к тугоплавкому, так и легкоплавкому компоненту (рис. 15, а). С помощью правила фаз можно доказать, что в этом случае линия ликвидуса должна коснуться линии солидуса в единственной точке, которая должна быть точкой минимума на обеих кривых. Сплав, соответствующий точке минимума, кристаллизуется при постоянной температуре подобно чистому компоненту. Встречается противоположный случай, когда кривые ликвидуса и солидуса имеют максимум, который является для них единственной общей точкой касания (рис. 15, б). Сплав, соответствующий максимуму, также кристаллизуется как чистый компонент.
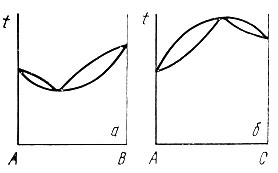
Рис. 15. Диаграмма состояния с .минимумом (а) и максимумом (б) на кривых солидуса и ликвидуса
|
ПОИСК:
|
© METALLURGU.RU, 2010-2020
При использовании материалов сайта активная ссылка обязательна:
http://metallurgu.ru/ 'Библиотека по металлургии'
При использовании материалов сайта активная ссылка обязательна:
http://metallurgu.ru/ 'Библиотека по металлургии'