
§ 3. Коррозия художественных изделий
Слово коррозия происходит от лат. corrodere - разрушаться и означает разрушение металлов. Этот процесс по своей природе чрезвычайно сложен и до конца еще не разгадан. Например, крыша на здании английского Парламента покрыта уральским железом в 1820 г.; с тех пор она ни разу не перекрывалась, не ремонтировалась и даже не красилась, так как на блестящих железных листах нет ржавчины!
Различают два типа коррозии: химическую и электрохимическую.
Химическая коррозия определяется чисто химическими процессами и главным образом окислением. Даже в среде сухого воздуха при комнатной температуре в результате воздействия кислорода воздуха на поверхности металлоизделий появляется тонкий слой окисла - окисная пленка, представляющая собой пример химической коррозии. При нагреве металла окисление усиливается. Окалина, образующаяся на раскаленной поверхности металла, также относится к явлению химической коррозии.
Электрохимическая коррозия в отличие от химической возникает при наличии физико-химической неоднородности металлов, в присутствии жидкости, способной проводить электрический ток.
Эти два типа коррозии не всегда можно разграничить, так как в воздухе всегда присутствует влага в виде водяных паров, которые легко конденсируются на поверхности изделия, и химическая коррозия переходит в электрохимическую.
Процессы, протекающие при электрохимической коррозии, сходны с явлениями, происходящими в гальваническом элементе. Для того чтобы началась электрохимическая коррозия, необходимы следующие условия: наличие двух разнородных металлов; контакт между ними; присутствие электролита.
Электролитом называется водный раствор солей, кислот или щелочей. Особенность таких растворов заключается в том, что молекулы солей, кислот или щелочей, растворяясь в воде, подвергаются диссоциации, т. е. распадаются на ионы, несущие положительные и отрицательные заряды.
В природе вода всегда содержит в растворенном состоянии те или иные химические вещества и является электролитом (только дистиллированная вода не может служить электролитом).
Установлено, что металлы обладают различной химической активностью, которая характеризуется электродным потенциалом, измеренным относительно водорода (потенциал которого условно принят равным нулю).
В табл. 6 приведены электродные потенциалы металлов, наиболее часто употребляемых в художественных изделиях. Такое последовательное расположение металлов в соответствии с их электродным потенциалом носит название электрохимического ряда напряжений.
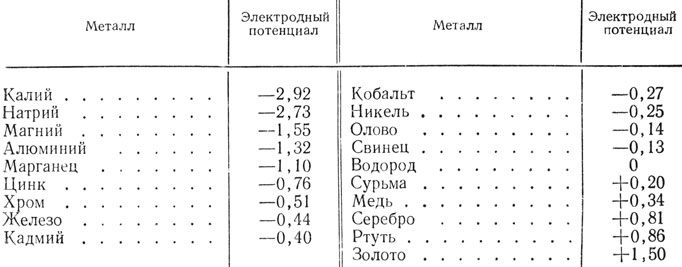
Таблица 6
Каждые два металла образуют гальваническую пару; при этом электродвижущая сила у них тем больше, чем дальше в ряду электрохимических напряжений стоят друг от друга взятые металлы. Это происходит потому, что электродвижущая сила равна разности потенциалов обоих металлов.
Например, если взять медь и железо, то разность их потенциалов равна 0,34-(-0,44) = 0,78; а пары железо-цинк соответственно -0,44-(-0,76) = 0,32. Следовательно, коррозия в первом случае будет протекать интенсивнее, чем во втором, примерно в два с лишним раза. Причем в первом случае разрушится железо, а во втором случае цинк.
Металл, который в паре имеет относительно меньший электродный потенциал и, следовательно, подвергается коррозии, называется анодом, а металл, обладающий относительно большим потенциалом,- катодом. Так, например, в первой паре медь - железо анодом является железо, а во второй паре железо - цинк анодом является цинк.
Кроме величины разности потенциалов на скорость коррозии влияет температура. С повышением температуры интенсивность коррозии увеличивается. Кроме того, на скорость коррозии влияет и концентрация электролита - чем выше концентрация, тем скорость больше. Наоборот, коррозия замедляется благодаря поляризации электродов, которая представляет собой скопление ионов анодного металла вблизи анода. Такое скопление ионов затрудняет доступ электролита к аноду и ослабляет его растворение. Это приводит к уменьшению электродвижущей силы, а следовательно, и замедлению коррозии.
По форме различают следующие виды коррозии.
Равномерная коррозия, которая возникает в тех случаях, когда потенциалы зерен металла очень мало разнятся между собой или одинаковы. Равномерная коррозия неопасна, так как происходит только поверхностное разрушение металла и образование оксидных пленок, состоящих из окислов металла и препятствующих распространению коррозии вглубь.
Равномерная коррозия относится к химической коррозии; примером может служить образование защитных оксидных пленок на алюминии.
Местная коррозия, которая наблюдается у сплавов с разными потенциалами зерен.
Все сплавы состоят из зерен двух или нескольких металлов. Но, как уже отмечалось, и в чистых металлах, за исключением самых высоких марок, всегда присутствуют примеси. Поэтому поверхность почти любого металлического изделия, если на него попадает вода (электролит), представляет собой как бы многоэлектродный элемент, в котором одни из зерен служат анодами, а другие катодами. Примером такого сплава является латунь. В образовавшейся гальванопаре зерна различных металлов или растворов подвергаются разрушению и растворению. Появляются пустоты, в них вновь проникает электролит, и процесс идет в глубину, латунное изделие разрушается.
Интеркристаллическая коррозия - наиболее опасная форма. Она возникает в тех случаях, когда различные части зерен, образующих сплавы, имеют неодинаковый потенциал. Например, грани зерен имеют меньший потенциал, чем центральные части зерен. В этом случае процесс коррозии протекает внутри зерен, причем разрушается их периферийная часть. Такой вид коррозии встречается иногда в алюминиевых сплавах и в хромоникелевых сталях при нарушении технологических норм их производства и термической обработки.
Растрескивающаяся коррозия, возникающая в деформированных металлах и являющаяся результатом образования гальванопары нагартованными и ненагартованными участками одного и того же металла или сплава.
Нагартованные участки обладают меньшим потенциалом по сравнению с недеформированными участками. Поэтому они становятся анодами и разрушаются. Кроме того, в деформированных изделиях всегда имеются внутренние напряжения, которые, действуя совместно с процессами коррозии, обусловливают образование трещин и разрывов. Например, клепаные изделия, в которых заклепки сделаны из того же металла, что и само изделие, все же подвергаются электрохимической коррозии; причем заклепки, как наиболее нагартованные, становятся анодом и разрушаются.
|
ПОИСК:
|
© METALLURGU.RU, 2010-2020
При использовании материалов сайта активная ссылка обязательна:
http://metallurgu.ru/ 'Библиотека по металлургии'
При использовании материалов сайта активная ссылка обязательна:
http://metallurgu.ru/ 'Библиотека по металлургии'