
Методы определения марганца
Определение марганца в чистых металлах и сплавах на медной основе
1. Персульфатносеребряный метод
Сущность метода. Метод основан на окислении иона двухвалентного марганца до семивалентного надсернокислым аммонием в присутствии катализатора - азотнокислого серебра.
Уравнение реакции:
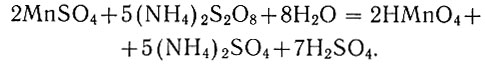
Ион МnО4- титруют раствором мышьяковистокислого натрия, который не реагирует ни с избытком персульфата, ни с хромат-ионами, образующимися при окислении надсернокислым аммонием.
Реакция протекает по уравнению:
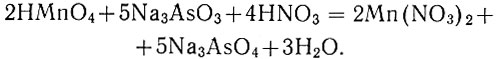
Реакция между ионами МnО4- и AsO33- нe протекает стехиометрически, поэтому следует пользоваться не теоретическим, а практическим титром.
Реактивы. Смесь кислот: 90 см3 серной кислоты (плотность 1840 кг/м3), 260 см3 азотной кислоты (плотность 1400 кг/м3), 100 см3 фосфорной кислоты (плотность 1700 кг/м3) и 550 см3 воды.
Выполнение определения. Навеску 0,5-1 г (в зависимости от содержания марганца) помещают в коническую колбу емкостью 300 см3, растворяют в 30 см3 смеси кислот и кипятят до удаления окислов азота.
Раствор разбавляют водой до 80-100 см3, нагревают до кипения, прибавляют 10 см3 раствора азотнокислого серебра (2,5 г/л), 20 см3 раствора надсернокислого аммония (200 г/л), доводят до кипения и кипятят в течение одной минуты.
Раствор охлаждают до комнатной температуры и быстро титруют мышьяковистокислым натрием на фоне меди до исчезновения розовой окраски.
Титр мышьяковистокислого натрия устанавливают по стандартному образцу, соответствующему по составу испытуемому, проведенному через все стадии анализа.
Процентное содержание марганца вычисляют по формуле:
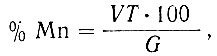
где V - количество см3 раствора мышьяковистокислого натрия, израсходованное на титрование;
Т - титр раствора мышьяковистокислого натрия, выраженный в г марганца;
G - навеска образца, г.
2. Висмутатный метод
Сущность метода. При взаимодействии ионов двухвалентного марганца с висмутатом натрия в азотнокислой среде проходит реакция окисления Мn2+ до иона МnО4-:
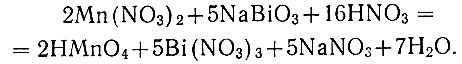
Определение заканчивают, производя титрование ионов МnО4- раствором мышьяковистокислого натрия или производя восстановление иона МnО4- раствором соли закиси железа с последующим титрованием избытка ионов Fe2+ раствором марганцовокислого калия.
Уравнение реакции:
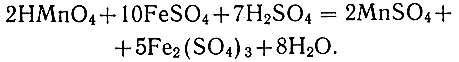
Выбор реактива для титрования зависит от того, присутствует хром или отсутствует. Если хром присутствует, то он реагирует с висмутатом натрия, окисляясь до хромат-иона, который взаимодействует с солью закиси железа. Поэтому в присутствии хрома применяют титрование мышьяковистокислым натрием или отделяют хром осаждением окисью цинка. Кроме хрома, определению марганца мешают кобальт, церий, ванадий.
Реактивы. 1. Кислота азотная, разбавленная 3:97, свободная от окислов азота, удаление которых достигается пропусканием через азотную кислоту (плотность 1400 кг/м3) струи кислорода или воздуха до обесцвечивания ее.
2. Натрий мышьяковистокислый, титрованный раствор:
А) 14 г As2O3 помещают в стакан, содержащий 42 г Na2CO3 и 800 см3 воды, и растворяют при нагревании и постоянном перемешивании. По растворении охлаждают и разбавляют водой до 2 л; Б) рабочий раствор: 100 см3 раствора А разбавляют водой до 1 л.
Титр раствора устанавливают по соответствующему стандартному образцу, проведенному через все стадии анализа.
3. Двойная сернокислая соль закиси железа-аммония, титрованный раствор: 12 г двойной сернокислой соли закиси железа-аммония растворяют в 1 л разбавленной (5:95) серной кислоты.
4. Калий марганцевокислый, титрованный раствор, 0,03-н.: 1 г марганцевокислого калия растворяют в 1 л воды. Приготовленный раствор оставляют стоять в течение шести суток и затем сифонируют или фильтруют через слой стеклянной ваты и прокаленного асбеста, не взмучивая осадка двуокиси марганца. Раствор хранят в склянке из темного стекла.
Титр раствора устанавливают не ранее следующего дня после сифонирования по стандартному образцу, проведенному через все стадии анализа, или по щавелевокислому натрию. Для этого берут навеску 0,08-0,1 г щавелевокислого натрия, просушенного до постоянного веса при температуре 105-110°С, помещают в коническую колбу емкостью 300 см3, прибавляют 100 см3 разбавленной серной кислоты (1:9), раствор нагревают до 70-80°С и титруют раствором марганцевокислого калия до появления устойчивой розовой окраски, сохраняющейся одну минуту.
Титр раствора марганцевокислого калия вычисляют по формуле:
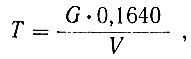
где Т - титр раствора марганцевокислого калия, выраженный в г марганца;
0,1640 - переводный множитель для пересчета от оксалата натрия на марганец;
G - навеска щавелевокислого натрия, г;
V - количество см3 раствора марганцевокислого калия, израсходованное на титрование взятой навески щавелевокислого натрия.
Выполнение определения. Навеску 0,5-1 г образца (в зависимости от содержания марганца) помещают в коническую колбу емкостью 300 см3, растворяют в 40 см3 разбавленной азотной кислоты (1:3) и кипятят до удаления окислов азота. В горячий раствор осторожно, порциями прибавляют 0,5 г висмутата натрия и кипятят до выпадения двуокиси марганца. Если при кипячении выпавшая двуокись марганца растворится, то прибавляют еще некоторое количество висмутата натрия.
Только после образования устойчивого осадка двуокиси марганца можно считать, что органические вещества полностью окислились. Не прекращая нагревания, из пипетки по каплям прибавляют раствор азотистокислого натрия (50 г/л) до момента полного растворения двуокиси марганца, затем прозрачный раствор кипятят в течение 15-20 мин до полного удаления окислов азота.
Охладив раствор до комнатной температуры, к нему прибавляют 1-2 г висмутата натрия и энергично взбалтывают в течение 1 мин, прибавляют 50 см3 разбавленной азотной кислоты (3:97) и снова тщательно перемешивают 2 мин.
Раствору дают постоять 5-10 мин и фильтруют через слой стеклянной ваты и прокаленного асбеста, предварительно промытого 5-6 раз разбавленной азотной кислотой (3:97). Колбу, в которой производилось окисление, и воронку с фильтрующим слоем тщательно промывают разбавленной азотной кислотой (3:97) до тех пор, пока капли стекающей жидкости не станут бесцветными.
Отфильтрованный раствор титруют мышьяковистокислым натрием до исчезновения розовой окраски раствора. Содержание марганца вычисляют по формуле:
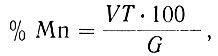
где V - количество см3 раствора мышьяковистокислого натрия, израсходованное на титрование;
Т - титр раствора мышьяковистокислого натрия, выраженный в г марганца;
G - навеска образца, г.
При титровании же двойной сернокислой солью закиси железа-аммония прибавляют ее к отфильтрованному раствору в избытке, который оттитровывают раствором марганцевокислого калия до устойчивой в течение 1 мин розовой окраски раствора.
Одновременно устанавливают соотношение между растворами двойной сернокислой соли закиси железа-аммония и марганцевокислого калия. Для этого из бюретки наливают точно отмеренное количество (20-30 см3) двойной сернокислой соли закиси железа-аммония и 100-150 см3 разбавленной серной кислоты (5:95) и титруют раствором марганцевокислого калия до слабо-розовой окраски, сохраняющейся 1 мин.
Процентное содержание марганца вычисляют по формуле:
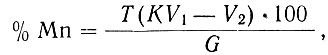
где Т - титр раствора марганцевокислого калия, выраженный в г марганца;
К - отношение количества см3 раствора марганцевокислого калия к эквивалентному объему раствора двойной сернокислой соли закиси железа-аммония;
V1 - количество см3 прибавленного раствора двойной сернокислой соли закиси железа аммония;
V2 - количество см3 раствора марганцевокислого калия, израсходованное на титрование избытка раствора двойной сернокислой соли закиси железа-аммония:
G - навеска образца, г.
3. Потенциометрический метод
Сущность метода. Метод основан на титровании ионов двухвалентного марганца раствором марганцевокислого калия в присутствии комплексообразователя - пирофосфата натрия в нейтральной или слабокислой среде.
Реакция протекает по уравнению:
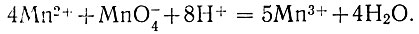
Реактивы. Титрованный раствор марганцевокислого калия, 0,01-0,2-н.: 0,9473-1,895 г марганцевокислого калия растворяют в 1 л воды. Приготовление раствора марганцевокислого калия см. в предыдущем методе.
Титр раствора марганцевокислого калия устанавливают по щавелевокислому марганцу, щавелевокислому натрию или по стандартному образцу, применяя для этого три навески, и находят среднюю величину из трех близко совпавших результатов.
Установка титра раствора марганцевокислого калия
а) по щавелевокислому натрию. Навеску 0,2 г щавелевокислого натрия растворяют в небольшом количестве воды. Раствор переносят в мерную колбу емкостью 50 см3. Берут аликвотную часть, 5 см3, прибавляют 100 см3 разбавленной серной кислоты (1:9), нагревают до температуры 70-80°С и титруют раствором марганцевокислого калия до слабо-розового окрашивания.
Титр раствора марганцевокислого калия, выраженного по марганцу, вычисляют по формуле:
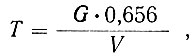
где G - навеска щавелевокислого натрия, г;
0,656 - переводный множитель от титра раствора марганцевокислого калия, выраженного по щавелевокислому натрию, к титру по марганцу;
V - количество см3 раствора марганцевокислого калия, израсходованное на титрование навески щавелевокислого натрия;
б) по стандартному образцу. Для установки титра раствора марганцевокислото калия берут стандартный образец, аналогичный по содержанию марганца, и проводят через все стадии анализа.
Титр раствора марганцевокислого калия по марганцу вычисляют по формуле:
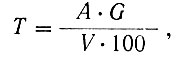
где Т - титр раствора марганцевокислого калия, выраженный в г марганца;
А - процентное содержание марганца в стандартном образце;
G - навеска стандартного образца, г;
V - количество см3 раствора марганцевокислого калия, израсходованное на титрование марганца, содержащегося во взятой навеске стандартного образца.
Выполнение определения. Навеску 3,0-5,0 г образца, в зависимости от содержания марганца, помещают в стакан емкостью 400 см3 и растворяют в 60-70 см3 разбавленной соляной кислоты (1:1) при слабом нагревании.
По растворении навески добавляют 3 см3 азотной кислоты (плотность 1400 кг/м3) и кипятят до полного удаления окислов азота. Охлажденный раствор переносят в мерную колбу емкостью 250 см3, разбавляют водой до метки и перемешивают.
В стакан емкостью 300-400 см3 вносят 10 г пирофосфорнокислого натрия, который растворяют при нагревании в 50 см3 воды. Берут аликвотную часть, 25 см3, испытуемого раствора и переносят в горячий раствор пирофосфорнокислого натрия в виде тонкой струи при энергичном перемешивании.
Раствор нейтрализуют по лакмусовой бумаге: в том случае, когда он красный - раствором углекислого натрия (200 г/л), если же лакмус синий - разбавленной соляной кислотой (1:1) до нейтральной реакции. Раствор титруют марганцевокислым калием некомпенсационным или компенсационным методом с парами электродов платина - насыщенный каломельный электрод или платина - вольфрам.
Процентное содержание марганца вычисляют по формуле:
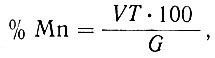
где V - количество см3 раствора марганцевокислого калия, израсходованное на титрование марганца, содержащегося во взятой навеске стали;
Т - титр раствора марганцевокислото калия, выраженный в г марганца:
G - навеска образца, г.
4. Фотоколориметрический метод
Сущность метода. Ион двухвалентного марганца окисляют надсернокислым аммонием в присутствии катализатора - азотнокислого серебра в интенсивно окрашенный ион марганцевой кислоты и измеряют светопоглощение последней.
Реактивы. Смесь кислот: 90 см3 серной кислоты (плотность 1840 кг/м3), 260 см3 азотной кислоты (плотность 1400 кг/м3), 100 см3 фосфорной кислоты (плотность 1700 кг/м3) и 550 см3 воды.
Непременным условием для выполнения данного определения является отсутствие в дистиллированной воде и во всех необходимых реактивах иона хлора, так как образовавшаяся в результате прибавления азотнокислого серебра муть исказит результаты измерения оптической плотности.
Выполнение определения. Навеску 0,1-0,5 г образца помещают в коническую колбу емкостью 100 см3 и растворяют в 15 см3 смеси кислот. По растворении кипятят до удаления окислов азота.
При наличии осадка (кремнекислоты) его отфильтровывают собирая фильтрат и промывные воды в мерную колбу емкостью 100 см3, раствор охлаждают, разбавляют водой до метки и хорошо перемешивают.
Берут пипеткой две порции по 10 см3, переносят их в конические колбы емкостью 100 см3, добавляют к каждой 20 см3 воды, 2 см3 раствора азотнокислого серебра (2,5 г/л), 2 см3 раствора надсернокислого аммония (250 г/л), нагревают до кипения и кипятят не более 1 мин.
К одной из порций анализируемого раствора добавляют 2-3 капли раствора селенистой кислоты, кипятят еще 1 мин для разрушения марганцевой кислоты, снимают растворы с плиты и охлаждают. Охлажденные растворы переливают в мерные колбы емкостью 50 см3, разбавляют водой до метки и тщательно перемешивают.
Фотометрирование производят, пользуясь зеленым светофильтром (длина волны 520-530 нм). Влияние других легирующих элементов, в частности ионов меди, учитывают начальной установкой нуль прибора по пробе, обработанной селенистой кислотой.
По найденной величине оптической плотности испытуемого раствора находят процентное содержание марганца методом калибровочной кривой или методом сравнения.
Для метода сравнения пользуются стандартным образцом с содержанием марганца, близким к испытуемому, и проводят его через все стадии анализа или стандартным раствором марганца, взятым в количестве соответствующем содержанию марганца в исследуемой пробе.
Процентное содержание марганца вычисляют по формуле:
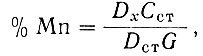
где Dx - оптическая плотность исследуемого раствора;
Dcт - оптическая плотность эталона сравнения;
Сст - содержание марганца в стандартном образце, %;
G - навеска образца, г.
|
ПОИСК:
|
© METALLURGU.RU, 2010-2020
При использовании материалов сайта активная ссылка обязательна:
http://metallurgu.ru/ 'Библиотека по металлургии'
При использовании материалов сайта активная ссылка обязательна:
http://metallurgu.ru/ 'Библиотека по металлургии'