
3. Восстановление элементов из их окислов
Восстановительный процесс - это химическое взаимодействие, в результате которого от окислов отнимается кислород. Восстановителями в доменной печи являются окись углерода, твердый углерод и водород. Назначение доменной плавки заключается в том, чтобы отнять кислород от окислов железа и ряда других элементов, содержащихся в шихтовых материалах.
Хорошее развитие процессов восстановления было бы невозможно без противотока газа и шихты.
Печные газы отдают тепло шихте, что обеспечивает протекание химических реакций, и удаляют газообразные продукты восстановления. На рис. 75 представлена кривая изменения температуры газа 1 и шихты 2 по высоте доменной печи.
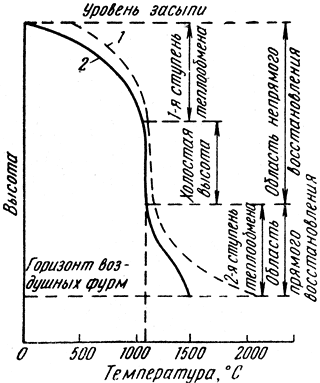
Рис. 75. Изменение температур газа и шихты по высоте доменной печи
С повышением температуры химическое сродство металлов к кислороду снижается, а к углероду возрастает, вследствие чего при соответствующих температурах он может служить восстановителем. Это используется в доменной плавке, где основными восстановителями являются твердый углерод и его окись. Углерод поступает в доменную печь с коксом и природным газом. Содержание метана (Сн4) в природном газе составляет 95 - 97%, а содержание углерода в коксе 85 - 87%.
Восстановление элементов в доменной печи происходит двумя путями: газами (окись углерода, водородом) и твердым углеродом. В первом случае восстановление называется непрямым (косвенным), а во втором - прямым.
Основные закономерности процесса восстановления железа из его окислов были выявлены акад. А. А. Байковым. Он установил последовательность превращений при восстановлении от высших окислов до металлического железа, которую можно представить в следующем виде:
Косвенное восстановление окисью углерода начинается при температурах 300 - 400°С и происходит по таким реакциям;
Общий тепловой эффект непрямого восстановления железа является положительным.
Восстановление водородом начинается при 300°С и протекает по такой же схеме, но все реакции сопровождаются поглощением тепла:
При восстановлении окислов железа твердым углеродом происходит большое поглощение тепла:
Первая реакция начинается при температуре 390 - 400°С, а вторая и третья - при 700 - 800°С. Взаимодействие твердых окислов с твердым углеродом кокса возможно только в точках их соприкосновения, т. е. реакционная поверхность значительно меньше, чем в случае восстановления газами. Однако если окись железа находится в жидкой фазе, то взаимодействие окиси с твердым углеродом протекает более интенсивно, так как жидкая фаза как бы омывает куски кокса (так же как и газ, содержащий окись углерода, или водород омывает куски агломерата или руды). Следует также учитывать, что твердый углерод в виде сажистого углерода откладывается в порах железной руды или агломерата, что резко увеличивает реакционную поверхность и способствует протеканию восстановительных процессов. Восстановление окислов железа по высоте доменной печи проиллюстрировано на рис. 76.
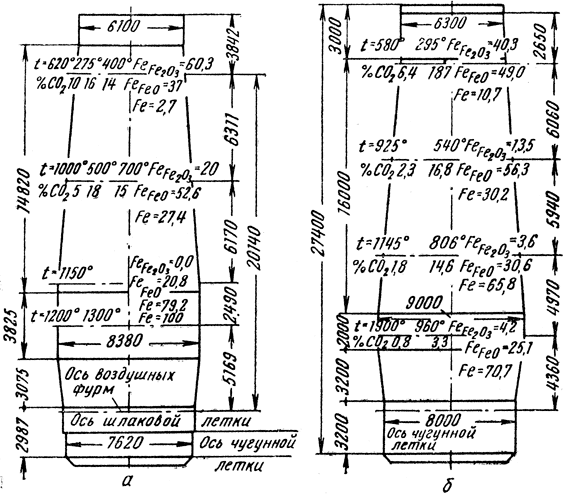
Рис. 76. Восстановление железа по высоте доменной печи: а - магнитогорская; б - завода 'Запорожсталь'
Агломерат или железная руда могут содержать силикаты железа. Такие соединения первоначально взаимодействуют с окисью кальция, имеющей большое сродство к кремнезему, в результате чего получаются силикаты кальция. Выделяющаяся при этом закись железа восстанавливается твердым углеродом со значительной, в конечном итоге, затратой тепла.
Чем больше в шихте содержится силикатов железа, тем больше расходуется горючего на выплавку чугуна. Чаще всего встречается силикат в виде Fe2SiО4, восстановление железа из которого происходит по реакциям:
Эти реакции начинают хорошо протекать при температуре 800 - 850°С. Силикаты железа могут восстанавливаться окисью углерода в незначительных количествах.
Непрямое восстановление сопровождается выделением небольшого количества тепла и требует много СО, получить которую можно только путем сжигания угле- рода в печи. При прямом восстановлении расходуется меньшее количество углерода, но требуется много тепла, которое можно получить в основном при сжигании углерода и путем нагрева дутья. Таким образом, в доменной печи в первом случае при получении необходимого количества окиси углерода выделяется тепло и во втором - получение тепла связано с образованием окиси углерода. Поэтому минимальный расход углерода на восстановление в целом может быть тогда, когда лучше используется восстановительная энергия газов в печи, что достигается оптимальным распределением в первую очередь шихтовых материалов на колошнике и хорошим качеством агломерата (отсутствие мелочи, достаточная прочность, хорошая восстановимость).
Процессы восстановления могут протекать быстро и медленно. Это зависит от ряда условий, в том числе от качества сырых материалов. Скорость восстановления зависит прежде всего от качества железной руды или агломерата. Под качеством необходимо понимать величину кусков, пористость, содержание трудновосстановимых окислов, пустой породы и т. д. Чем больше размер куска руды или агломерата, тем больше затрачивается времени на его восстановление. На рис. 77 показана зависимость между размером кусков руды и степенью восстановления.
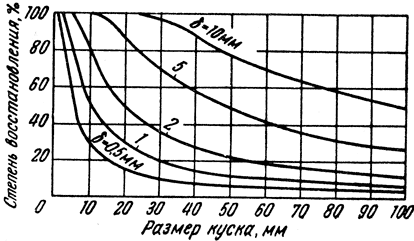
Рис. 77. Зависимость между величиной куска и степенью восстановления
Однако не только величина куска, но и его пористость (в большей степени) влияет на скорость восстановления. Чем более пориста руда, тем лучше ее восстановимость (агломерат является более пористым сырьем, чем руда). Чем больше в агломерате силикатов железа и его закиси, тем резче снижается восстановимость. Объясняется это тем, что с увеличением содержания FeO температура размягчения агломерата понижается, что приводит к образованию "тестообразных" масс, закрывающих поры и ухудшающих доступ газа к окислам. Такое явление может происходить и у руд, если температура их размягчения низкая.
На рис. 78 представлены зависимости степени восстановления от содержания в агломерате закиси железа. Как видно из диаграммы, агломерат при температуре 1100°С восстанавливается хуже, чем при 1000°С (при одинаковом содержании FeO). Это вызвано тем, что в данном случае агломерат при более высокой температуре размягчается, теряет пористость и окислы контактируют с газом только на поверхности куска.
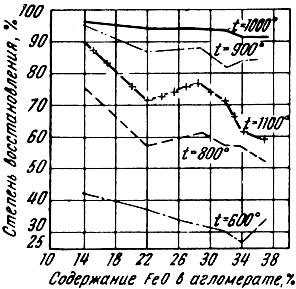
Рис. 78. Зависимость степени восстановления агломерата от содержания в нем закиси железа
Скорость восстановительных процессов во многом зависит от состава газа-восстановителя. Увеличение содержания в газовой смеси углекислоты и паров воды тормозит восстановление. Чем больше в отходящем из доменной печи газе додержится углекислоты, тем более полно была использована его восстановительная способность. Однако не следует забывать, что в состав отходящих газов входит и СО2, выделившаяся вследствие разложения карбонатов (в частности, известняка).
Поэтому применение офлюсованного агломерата, помимо прочих преимуществ, позволяет освободить печь от дополнительного количества углекислоты.
Азот - инертный газ. Он непосредственно в процессе не участвует, а лишь увеличивает общее количество газа, проходящего через столб шихты, и разбавляет газ-восстановитель, что является отрицательным фактором. Поэтому определенное обогащение вдуваемого кислородом воздуха позволяет снизить содержание азота в газе и увеличить количество окиси углерода. Однако, не участвуя непосредственно в процессах восстановления, азот является основным переносчиком тепла по высоте доменной печи. Поэтому резкое уменьшение его содержания во вдуваемом воздухе (например, путем значительного обогащения дутья кислородом без проведения дополнительных специальных мероприятий) приведет к недостатку тепла в верхних частях доменной печи и к протеканию основных реакций только на нижних горизонтах. В результате материалы придут к горну неподготовленными.
Одновременно с железом в доменной печи восстанавливаются и переходят частично или полностью в чугун Si, Mn, S, Р и другие элементы. Некоторые элементы в виде окислов или соединений входят в состав шихты, некоторые из них специально вводят в шихту для получения их в составе чугуна. В частности, для получения марганцовистых чугунов в шихту вводят марганцевую руду, в которой могут содержаться следующие окислы марганца: перекись Мn2O, окись Мn2О3, закись-окись Мn3О4 и закись МnО.
Перекись и окись марганца относятся к непрочным соединениям и при воздействии на них окиси углерода отдают часть своего кислорода: первая - при температуре 565°С и вторая - при 1090°С. Закись марганца восстанавливается только твердым углеродом, что сопровождается большим поглощением тепла.
Восстановление марганца проходит по схеме:
Окончательное восстановление марганца из его закиси сопровождается затратой тепла, примерно в два раза большей, чем восстановление железа из его закиси. Значительная часть закиси марганца, не успев восстановиться, соединяется с кремнекислотой и образует трудновосстановимое соединение - силикат марганца:
восстановление марганца из которого начинается при температуре не ниже 1300°С твердым углеродом и сопровождается большим поглощением тепла. При этом кремнекислота соединяется с окисью кальция по реакции
Раньше марганцевая руда при выплавке мартеновских чугунов потреблялась в больших количествах. Марганец частично соединяется с серой с образованием соединения MnS, которое удаляется со шлаком. Добавка марганцевой руды в шихту может преследовать и другие цели. При выплавке ферромарганца, или зеркального чугуна, марганец является составной частью ферросплава.
Некоторые заводы, главным образом на Юге страны, и сейчас выплавляют мартеновские чугуны с несколько повышенным содержанием марганца. Это объясняется повышенным содержанием серы в южных коксах.
Помимо того, что восстановление марганца требует большой затраты тепла, вместе с марганцевой рудой вносится также дополнительно пустая порода в виде кремнезема и глинозема, что увеличивает количество шлака. В отличие от железа марганец переходит не полностью в чугун и, восстановившись, может испаряться и уноситься газами. При высоких температурах, особенно в нижних горизонтах печи, во время выплавки ферромарганца испарение может происходить довольно интенсивно, чему способствует также большая скорость газов. Если железо при выплавке обычных чугунов распределяется между чугуном и колошниковой пылью, то марганец распределяется между чугуном, пылью и шлаком, куда его переходит чуть ли не половина. Все это делает невыгодным использование марганцевой руды при выплавке обычных чугунов.
Следующим элементом, который обязательно присутствует в чугуне, является кремний. Окислы кремния находятся во всех видах сырья, применяемого в доменной плавке (даже в золе кокса). Окислы или другие соединения кремния в шихту доменных печей, как правило, при выплавке передельных чугунов специально не добавляют.
Кремнийсодержащие породы, такие как кварциты, применяют только при выплавке доменного ферросилиция, а чистый кварц - при выплавке высококремнистого ферросилиция в электропечах. Кремний образует соединения не только с кислородом, но и с железом, марганцем и другими элементами. Восстановление кремния в доменной печи происходит твердым углеродом и сопровождается очень большим поглощением тепла:
Чем выше содержания кремния в чугуне, тем больше расходуется горючего. На каждый процент кремния (свыше 0,7%) в чугуне необходимо около 0,1 т дополнительного расхода кокса на 1 т чугуна.
Восстановление кремния в присутствии железа начинается при температуре 1050°С, а без железа - при 1360°С. В противоположность марганцу кремний лучше восстанавливается при более кислых шлаках, так как образует кислые окислы.
К вредным примесям относятся сера, фосфор и мышьяк. Сера вносится в доменную печь рудами (агломератом), добавками, заменителями руд и коксом. Заводы Юга располагают относительно чистыми по сере рудами, но большое количество серы в южных коксах делает весьма высоким содержание ее в шихте доменных печей. В руде и флюсе сера может быть в виде пирита (FeS2) или сульфатов (CaSO4 и BaSO4), в коксе может быть в свободном виде, в соединении с углеродом или в виде сульфатов и сульфидов в золе кокса.
Сера распределяется между чугуном, шлаком, газом и пылью примерно так, как указано в табл. 14. Как видно из таблицы, большая часть серы остается в шлаке.
Сера может улетучиваться в виде паров, сернистого газа (SO2), сероводорода (H2S) и других газообразных соединений. С увеличением температуры процесс улетучивания серы из ряда ее соединений возрастает. Улетучивание сульфатной серы происходит следующим путем:
Однако если бы образующиеся в печи сернистые газы уносились из печи вместе с колошниковым газом полностью, то было бы очень легко бороться с серой в доменной печи.
Сернистое газообразное соединение SO2 при движении в печи вместе с газами быстро восстанавливается твердым углеродом и водородом, образуя соединения CS, CS2, COS, HS и H2S. Из этих соединений сера жадно поглощается шихтой, образуя сернистое железо и сернистый кальций, которые вместе с шихтой опускаются в низ печи.
Таблица 14
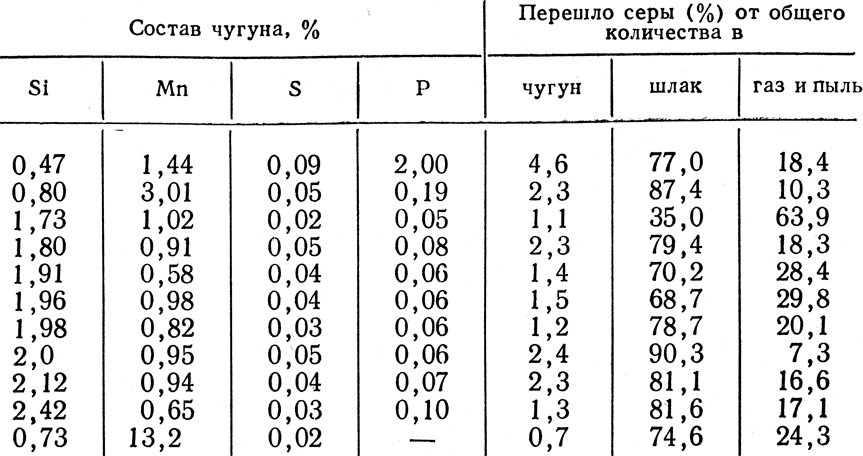
Вследствие того, что большая часть серы остается в доменной печи, получение чугуна, требуемого по сере состава, возможно только при таком составе шлака, который сможет поглотить основную ее массу, предупредив ее переход в чугун.
Фосфор и мышьяк ведут себя в доменной печи примерно одинаково. Они переходят в чугун почти полностью, за исключением тех количеств, которые могут улетучиться. Так как эти элементы вносятся в печь шихтовыми материалами в виде различных соединений (мышьяк в условиях СССР редко встречается), то они вначале восстанавливаются, а затем растворяются в чугуне. Так, например, восстановление фосфора из фосфата кальция происходит с помощью углерода и кремнекислоты при очень большом поглощении тепла:
Восстановленный фосфор энергично испаряется и немедленно соединяется с восстановившимся железом. Поэтому он практически с газами не выносится.
Очень нежелательной примесью железных руд является цинк. Он в железных рудах встречается в виде сернистого соединения - сфалетита (цинковой обманки) или в виде кремне- и углекислых солей. Эти соединения под действием окиси кальция превращаются в окись цинка, которая восстанавливается газами при температуре более 450°С. Восстановленный цинк в чугун не переходит и, не доходя до горна, испаряется. Часть цинка уносится газами, а часть конденсируется, оседая на кусках шихты или на стенках шихты. Последнее приводит к разрушению огнеупорной кладки и образованию настылей.
Хорошо восстанавливаются в доменной печи никель и медь. Ванадий и хром восстанавливаются, но несколько труднее, и процессы восстановления их протекают примерно по такой же схеме, как и при восстановлении марганца. Хром, никель и медь, восстановившись, полностью переходят в чугун.
В условиях доменной плавки ванадий и титан переходят в чугун частично. Свинец очень хорошо восстанавливается, но в чугуне не растворяется, а из-за высокого удельного веса скапливается на лещади и способствует ее разрушению.
Окислы кальция, магния и алюминия в доменной печи не восстанавливаются, а полностью переходят в шлак.
Бокс для продажи ломов купить от производителя: цены на боксы для продажи смотреть.
|
ПОИСК:
|
При использовании материалов сайта активная ссылка обязательна:
http://metallurgu.ru/ 'Библиотека по металлургии'